Постменопаузный остеопороз
О.В. Якушевская
Отделение гинекологической эндокринологии, ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава РФ, Москва
Постменопаузальный остеопороз (ОП) – системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники костной ткани, которые приводят к повышенной хрупкости костей, являясь одной из социальных проблем в развитых странах мира [1]. Частота заболеваемости ОП увеличивается с возрастом, а связанные с ним осложнения растут с увеличением продолжительности жизни. Особенно актуальны эти проблемы для женщин и определяются широкой распространенностью среди населения, многофакторной природой, высокой частотой инвалидизации, а в ряде случаев смертельными исходами [2]. Поэтому профилактика ОП и снижение риска переломов остается первостепенной задачей клиницистов.
Остеопороз (ОП) – одна из важных медико-социальных проблем в развитых странах мира. Частота заболеваемости ОП увеличивается с возрастом, а связанные с ним осложнения растут с увеличением продолжительности жизни. Согласно подсчетам, в Российской Федерации ОП страдают 14 млн человек (10 % населения страны), еще 20 млн имеют остеопению. Таким образом, у 34 млн человек присутствует высокий риск переломов [2].
В структуре первичного ОП на долю постменопаузального приходится 85 % случаев заболевания. Женщины в 2 раза чаще имеют риск развития ОП и переломов, связанных с ним. Среди городского населения России 24 % женщин в возрасте 50 лет и старше имеют один остеопоретический перелом. По данным Всемирной организации здравоохранения, средняя продолжительность жизни женщин в России составляет 72 года. Около 20 лет приходится на период постменопаузы, т.е. на время высокого риска развития ОП и риска остеопоротических переломов, главным образом костей запястья, ребер, тел позвонков, шейки бедренной кости [2].
Прогрессирование ОП характеризуется значительным снижением минеральной плотности костной ткани (МПКТ), нарушением ее микроархитектоники, что приводит к повышению хрупкости костей и риску низкотравматичных переломов. Потеря плотности кости происходит постепенно, скрыто и часто диагностируется уже после случившихся переломов, что и дало основание назвать ОП «безмолвной эпидемией» [3].
Как показали эпидемиологические исследования, в течение первых 5 лет после наступления менопаузы потеря костной массы у женщин может составить до 30 %. Так, для 50-летней женщины риск перелома позвоночника составляет в среднем 15,5 %, шейки бедра – 17,5 %, костей запястья – 16,0 %.
Старение популяции приводит к непропорциональному увеличению числа переломов. Согласно прогнозу, в Российской Федерации 1 из 3 женщин после 80 лет на фоне ОП получит перелом шейки бедра. Как показали международные исследования, у женщин в возрасте старше 65 лет, остеопоротические переломы шейки бедра составляют 90 % [3].
Профилактика любого заболевания эффективнее, надежнее и дешевле лечения и предусматривает первоочередное воздействие на центральное звено его патогенеза. При постменопаузальном ОП в основе наблюдаемых изменений в костях лежит ослабление костнопротективного эффекта половых стероидов на фоне их абсолютной недостаточности. Это предполагает, что заместительную гормональную терапию (ЗГТ) препаратами женских половых стероидов вполне обоснованно можно рассматривать как «первую линию» лечебных воздействий, направленных на обеспечение сохранности МПКТ в условиях гипоэстрогении. Установлено, что эстрогены – эффективные антирезорбтивные средства, позволяющие сохранять архитектуру костных трабекул в постменопаузе [4].
Селективные модуляторы эстрогеновых рецепторов (СМЭР) действуют как агонисты эстрогенов в одних органах (сердечно-сосудистая система, костная ткань) и как антагонисты – в других (матка, молочная железа). В настоящее время собраны убедительные данные, согласно которым селективные модуляторы эстрогеновых рецепторов служат эффективным и перспективным препаратом профилактики ОП, возможно, сердечно-сосудистых заболеваний у женщин в менопаузе. Использование СМЭР позволяет расширять профилактические возможности женщин, имеющих какие-либо противопоказания к назначению классической ЗГТ [5].
Тиболон претерпел длительный этап испытаний длиною в 25 лет, прежде чем его одобрили в качестве коррекции эстрогендефицитных состояний. Тиболон впервые синтезировали в 1964 г. в Нидерландах (Ливиал, Organon), а в настоящее время он успешно синтезируется в Словацкой Республике (Ледибон, ZENTIVA). Препарат зарегистрирован в 91 стране для лечения климактерического синдрома и в 55 странах для профилактики ОП. На этапе доклинических и клинических испытаний было выявлено, что тиболон обладает эстрогенной, прогестагенной и андрогенной активностью. Однако было трудно объяснить отсутствие его стимулирующего эстрогенного влияния на молочные железы и эндометрий. В результате интенсивного изучения механизма действия тиболона и его метаболитов установлена их тканеселективная активность в различных органах и тканях, на основании которой препарат отнесен к группе СМЭР [6].
По химической структуре тиболон является 19-норстероидным прогестином. Введение 7α-метильной группы в норэтинодрел, который имеет двойную связь в положении 5–10, резко изменило его прогестагенные свойства и способствовало развитию эстрогенных. Биопробы показали, что тиболон может имитировать активность всех трех половых стероидов. Эстрогенное и анаболическое влияние тиболона поддерживает положительный баланс кальция в организме, и данное свойство стало отправной точкой для последующих исследований, касающихся метаболических заболеваний костей [7].
В 1979 г. проведены детальные исследования метаболитов тиболона. Осуществить радиоиммунологический анализ in vitro/in vivo не представлялось возможным, т.к. тиболон очень быстро подвергался метаболизму. Исследование «меченого» тиболона продемонстрировало образование его трех основных метаболитов. После приема внутрь тиболон под влиянием ферментов 3α- и 3β-гидроксистероиддегидрогеназ и изомеразы в печени и тонком кишечнике превращается в три биологически активных метаболита: 3α-, 3β-гидрокси (3α- и 3β-ОН) метаболиты и Δ4-изомер. Гидроксильные метаболиты тиболона исключительно связываются с эстрогеновыми рецепторами, а третий, Δ4-изомер, связывается с рецепторами к прогестерону и рецепторами к андрогенам. Оба 3-гидроксиметаболита являются агонистами эстрогеновых рецепторов у человека. Хотя эти метаболиты слабее эстрадиола, но эстрогенный ответ объясняется их высоким уровнем в кровотоке. Оба метаболита, обладающих эстрогенной активностью, быстро попадают в кровоток, при этом уровень 3α-ОН метаболита в 3 раза выше, чем 3β-ОН. Период полураспада 3α-ОН и 3β-ОН метаболитов в кровотоке составляет 7–8 часов, но они могут определяться в кровотоке в низких концентрациях в течение 5 дней. 3α-ОН и 3β-ОН метаболиты обладают большим родством с α-эстрогеновыми рецепторами (α-ER), чем с β-ER [8, 9].
Таким образом, ассоциированная активность трех метаболитов определяет гормональное влияние тиболона на органы-мишени. Около 80 % метаболитов тиболона существует в кровотоке в неактивных моно- и дисульфатных формах, которые под влиянием фермента сульфатазы могут превращаться в активные на локальном тканевом уровне [9].
Первое многоцентровое исследование тиболона в лечении ОП стартовало в 1971 г., но его не удалость закончить из-за отсутствия стандартизации измерения МПКТ в различных центрах и получения различных результатов. В 1973 г. было начато новое исследование. Изначально участницы исследования получали более высокие дозы тиболона (2,5 мг 2 раза в сутки). Через 3 месяца доза была снижена до 1,25 мг 2 раза в сутки. Использование тиболона постменопаузальными женщинами с ОП в различных дозах в течение 2 лет не сопровождалось потерей МПКТ по сравнению с группой плацебо. При исследовании меньшей дозы существенно сокращалась выраженность климактерических проявлений и улучшение настроения. При анализе биоптатов эндометрия женщин, использующих тиболон, гиперплазии выявлено не было [10].
В 1982 г. с помощью биопроб анализировался гормональный профиль тиболона. Эстрогеновая активность – такая же, как у этинилэстрадиола, составила 10 %, прогестероновая, как у норэтистерона, – 12 %, анрогенная, как у метилтестостерона, – 2 %. Относительная связывающая аффинность для Δ4-метаболита составила 30 % по сравнению с дигидротестостероном, обладающим данным свойством на 100 %.
Присоединение 7α-метильной группы к структуре тиболона привело к увеличению эстрогенных свойств и уменьшению прогестероновой активности по сравнению с норэтинодрелом [11].
Тиболон проявляет эстрогенное влияние и на костную ткань, связываясь с эстрогеновыми рецепторами.
В своих исследованиях это подтвердили Ederveen и соавт. в 2001 г. [12].
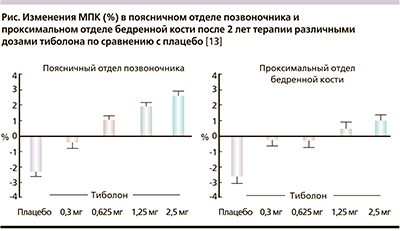
J.C. Gallagher и соавт. в своем исследовании с участием 770 женщин попытались определить минимально эффективные дозы тиболона в профилактике потери МПКТ у женщин в постменопаузе. На протяжении 2 лет было изучено несколько доз тиболона (0,3; 0,625; 1,25; 2,5). Все дозы (кроме 0,3 мг в сутки) прогрессивно увеличивали МПКТ в поясничном отделе позвоночника и общем бедре на протяжении всего периода наблюдения. При использовании дозы в 0,3 мг динамики изменения МПКТ в общем бедре не регистрировали. Установлено, что разницы средних процентных изменений МПКТ в сопоставлении с исходным уровнем в позвоночнике и всей бедренной кости были статистически значимы (p < 0,05) для всех доз тиболона по сравнению с плацебо. Достоверное увеличение МПКТ шейки бедра отмечено начиная с дозы 1,25 мг/сут [13]. Основные результаты продемонстрированы на рисунке.
В длительном открытом нерандомизированном исследовании женщин в постменопаузе изучалась реакция МПКТ на тиболон по сравнению с плацебо. Результаты подтвердили, что спустя 8 лет с момента начала терапии в основной группе имело место значительное увеличение МПКТ как в поясничном отделе позвоночника (4,1 %), так и в шейке бедренной кости (4,6 %; р < 0,05). В группе женщин, получавших плацебо, установлено снижение МПКТ в соответствующих отделах скелета [14].
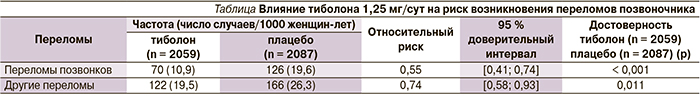
На основании полученных данных начато исследование LIFT (Longterm Intervention on Fractures with Tibolone trial) по определению влияния тиболона в дозе 1,25 на риск переломов при ОП у пожилых женщин. В исследование были включены 4538 женщин в постменопаузе. Средний возраст участниц составил 68,3 года. Оценка МПКТ в поясничном отделе позвоночника и в бедренной кости проведена с помощью двухэнергетической абсорбциометрии; T-критерий соответствовал ОП. Полученные результаты позволили сделать вывод: тиболон в дозе 1,25 мг/сут снижает риск как первичных, так и повторных переломов поясничного отдела позвоночника (см. таблицу) [15].
Таким образом, изучение кинетики и механизма действия тиболона и его метаболитов показало сложность его влияния в различных органах и тканях. С одной стороны, по химической структуре он относится к гормонам и, следовательно, используется как гормонотерапия при эстрогендефицитных состояниях. С другой – наряду непосредственно с гормональным воздействием тиболон оказывает влияние через ферментную регуляцию в отдельно взятых органах (молочной железе, эндометриий, костной ткани и др.). На основании многочисленных исследований как на животных, так и на человеке тиболон был отнесен к достоверно эффективным препаратам, которые могут применяться с заместительной целью женщинами в период постменопаузы, восполняя уровень эстрогенов и предотвращая потерю МПКТ после менопаузы или овариэктомии.
Литература
- Лесняк О.М. Аудит состояния проблемы остеопороза в странах восточной Европы и центральной Азии 2010. Остеопороз и остеопения. 2011;2:3–6.
- Лесняк О.М., Беневоленская Л.И. Клинические рекомендации «Остеопороз. Диагностика, профилактика и лечение». М., 2009.
- Михайлов Е.Е., Беневоленская Л.И. Эпидемиология остеопороза и переломов. В кн. «Руководство по остеопорозу». М., 2003. С. 10–53.
- Сметник В.П., Кулаков В.И. Руководство по климактерию. М., 2001.
- Overbeek G.A., van Vliet N.P., van der Vies J., et al. The infl uence of steroids on the skeleton. Arch Int Pharmacodyn Ther. 1969;182:420.
- Sandker G.W., Vos R.M., Delbressine L.P. Metabolism of three pharmacologically active drugs in isolated human and fat hepatocytes: analysis of interspecies variability and comparison with metabolism in vivo. Xenobiotica. 1994;24:143–55.
- Tax L., Goorissen E.M., Kicovic P.M. Clinical profile of Org OD14. Maturitas. 1987(Suppl 1):3–13.
- Vos R.M., Krebbers S.F., Verhoeven C.H., Delbressine L.P. The in vivo human metabolism of tibolone. Drug Metab. Dispos. 2002;3:106–12.
- Markiewicz L., Gurpide E. In vitro evaluation of estrogenic, estrogen antagonistic and progestagenic effects of a steroidal drug (Org OD-14) and its metabolites on human endometrium. J. Steroid Biochem. 1990;35:535–41.
- Lindsay R., Hart D.M., Kraszewski A. Prospective doubleblind trial of synthetic steroid (Org OD 14) for preventing postmenopausal osteoporosis. Br. Med. J. 1980;280:1207–09.
- de Gooyer M.E., Deckers G.H., Schoonen W.G., et al. Receptor profi ling and endocrine interactions of tibolone. Steroids. 2003;68:21–30.
- Ederveen A.G., Kloosterboer H.J. Tibolone exerts its protective effect on trabecular bone loss through the estrogen receptor. J. Bone Miner Res. 2001;16:1651–57.
- Gallagher J.C., Baylink D.J., Freeman R., McClung M. Prevention of bone loss with tibolone in postmenopausal women: results of two randomized, double-blind, placebo-controlled, dose-fi nding studies. J. Clin. Endocrinol. Metab. 2001;86:4717–26.
- Rymer J., Robinson J., Fogelman I. Effects of 8 years of treatment with tibolone 2.5 mg daily on postmenopausal bone loss. Osteoporos Int. 2001;12:478–83.
- Cummings S.R., Ettinger B., Delmas P.D. The effects of tibolone in older postmenopausal women. N. Engl. J. Med. 2008;359:697–708.
Об авторах / Для корреспонденции
О.В. Якушевская – к.м.н., научный сотрудник отделения гинекологической эндокринологии, ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» МинздраваРФ; e-mail: Ykushox83@mail.ru
Постменопаузальный остеопороз
Постменопаузальный остеопороз — патологическая деструкция костной ткани, вызванная системными обменными нарушениями вследствие гипоэстрогении. В половине случаев протекает скрыто и диагностируется после возникновения перелома. Может проявляться болями в крестце, пояснице, межлопаточной области, костях таза, предплечья и голени, искривлением позвоночника, уменьшением роста. Диагностируется при помощи денситометрии, определения уровня кальция, фосфора, маркеров костной резорбции, кальцитонина, паратгормона. Для лечения используют гормональные средства, ингибиторы остеорезорбции, стимуляторы остеосинтеза, препараты кальция и витамина D.
МКБ-10

Общие сведения
Первичный постменопаузальный остеопороз — наиболее распространенный вариант остеопоретической болезни, составляющий более 85% в структуре этого метаболического заболевания костно-мышечной системы. По данным ВОЗ, денситометрически подтвержденное снижение минеральной плотности костей и нарушение их микроархитектоники наблюдается у 30-33% женщин старше 50 лет. В России частота типичных для остеопороза переломов предплечья составляет более 560 случаев на 100 тысяч пациенток постменопаузального возраста, остеопоретических переломов бедра — свыше 120 на 100 тыс. Социальная значимость патологии определяется ее влиянием на инвалидизацию и смертность пожилых женщин.

Причины
Уменьшение костной массы и нарушение микроархитектоники костей во время постменопаузы связано с инволютивными процессами, происходящими в женском организме, и возрастным изменением стиля жизни. Специалисты в сфере гинекологии подробно изучили причины расстройства и предрасполагающие факторы. К возникновению остеопороза у пожилых женщин приводят:
- Снижение уровня эстрогенов. Женские половые гормоны участвуют в метаболизме кальция — важного структурного компонента костей, обеспечивающего их прочность, обновление и восстановление костной ткани. Гипоэстрогения развивается при недостаточности или угасании функции яичников, медикаментозном подавлении секреции эстрогенов, хирургическом удалении органа у пациенток с опухолями, эндометриозом, внематочной беременностью.
- Нерациональное питание. Дефицит кальция возникает при ограниченном потреблении молокопродуктов, рыбы, диетических сортов мяса, бобовых, зелени, овощей, фруктов на фоне избытка легкоусвояемых углеводов, жиров, кофе, крепкого чая. Подобный рацион отличается низким содержанием кальция, веществ, которые способствуют усвоению минерала организмом, и повышенной концентрацией ингибиторов его всасывания в кишечнике.
- Низкая двигательная активность. С возрастом подвижность женщины уменьшается. Ситуация усугубляется снижением времени естественной инсоляции, наличием избыточного веса, заболеваний и патологических состояний, ограничивающих способность к самостоятельному передвижению, — длительным постельным режимом при лечении хронической соматической патологии, последствиями перенесенных нарушений мозгового кровообращения и инфарктов.
Факторами риска возникновения остеопороза в постменопаузальный период являются возраст, превышающий 65 лет, принадлежность к европеоидной расе, ранний климакс, дефицит массы тела, наличие в анамнезе дисгормональных расстройств, курение, злоупотребление спиртным. Не исключено влияние наследственности – заболевание чаще выявляют у женщин, близкие родственники которых страдали остеопорозом или имели частые переломы. Вероятность поражения костной системы также повышается при более чем трехмесячном приеме глюкокортикоидных препаратов, оказывающих влияние на кальциевый обмен.
Патогенез
При постменопаузальном остеопорозе нарушается баланс между остеосинтезом и остеорезорбцией — основными механизмами ремоделирования костной ткани. На фоне дефицита эстрогенов снижается секреция кальцитонина — гормона щитовидной железы, являющегося функциональным антагонистом паратгормона, повышается чувствительность костной ткани к резорбтивному действию гормона паращитовидной железы. Основной эффект паратгормона — увеличение концентрации кальция в крови за счет усиленного транспорта через кишечную стенку, реабсорбции из первичной мочи и остеорезорбции. Параллельно с этим активируются остеокласты — клетки, разрушающие костную ткань, инсулиноподобные факторы роста 1 и 2, остеопротогерин, трансформирующий β-фактор, колониестимулирующий фактор и другие цитокины, усиливающие костную резорбцию.
Дополнительными элементами патогенеза, способствующими развитию остеопороза, становятся ухудшение всасывания минерала из-за субатрофии кишечного эпителия и дефицита витамина D, для достаточной секреции которого требуется более длительное пребывание на солнце. Снижение двигательной активности в постменопаузальном периоде приводит к уменьшению динамических нагрузок на костно-мышечный аппарат, что также замедляет процессы его ремоделирования. Ситуация усугубляется ухудшением всасывания кальция в кишечнике и его усиленной экскрецией с мочой при приеме глюкокортикоидов, часто применяемых в схемах лечения эндокринных, аутоиммунных, воспалительных и других болезней, которыми страдают пожилые пациентки.
Симптомы постменопаузального остеопороза
Практически у половины женщин заболевание протекает бессимптомно и выявляется только после перелома, вызванного незначительной травмой. В остальных случаях симптоматика прогрессирует постепенно. По мере потери костной массы пациентка начинает ощущать боли в пояснично-крестцовой области, усиливающиеся во время поднятия тяжелых предметов, поворотов, ходьбы. В последующем появляется ощущение тяжести в межлопаточном пространстве, болезненность в тазовом кольце, длинных трубчатых костях голени. Чтобы избавиться от болей и дискомфорта, на протяжении дня требуется дополнительный отдых в положении лежа.
Нарастание интенсивности болезненных ощущений приводит к тому, что со временем они беспокоят больную даже в состоянии покоя. Обычно нарушение осанки и искривление позвоночника сопровождается кифозом. Часто женщины постменопаузального возраста с остеопорозом жалуются на слабость, быструю утомляемость при физических нагрузках. Крайними формами проявления патологии становятся компрессионные переломы нижнегрудных и верхних поясничных позвонков с уменьшением их высоты, спонтанные или возникающие при незначительных нагрузках переломы лодыжек, костей предплечья, шейки бедра. Характерный признак — снижение роста на несколько сантиметров за год.
Осложнения
Наиболее серьезным последствием постменопаузального остеопороза является инвалидизация вследствие искривления позвоночника и частых переломов конечностей, усугубляемых постоянными болевыми ощущениями в костях. Пациентке сложно передвигаться не только на большие расстояния, но и по дому, ухаживать за собой, выполнять простые бытовые действия. Существенное ухудшение качества жизни может спровоцировать эмоциональные расстройства — тревожность, плаксивость, ипохондричность, склонность к депрессивному реагированию. У части женщин с остеопорозом отмечается длительная бессонница.
Диагностика
При выявлении у пациентки постменопаузального возраста компрессионных изменений позвоночника или типичных переломов конечностей в первую очередь необходимо исключить остеопороз. С диагностической целью используют методы, позволяющие оценить архитектонику костной ткани и степень ее насыщенности кальцием, а также обнаружить биохимические маркеры поражения костей. Наиболее информативными являются:
- Денситометрия. Современные двухэнергетические рентгеновские остеоденситометры с высокой точностью определяют, насколько снижена плотность костной ткани. С их помощью легко оценивать минерализацию «маркерных» костей (предплечья, тазобедренного сустава, поясничных позвонков) и всего организма. Метод применим для диагностики ранних стадий постменопаузального остеопороза. Вместо классического двухэнергетического исследования может выполняться ультразвуковой скрининг плотности костей (эходенситометрия), КТ-денситометрия.
- Биохимическое исследование крови. В ходе лабораторных анализов определяют содержание кальция, фосфора и некоторых специфических маркеров, свидетельствующих о нарушении ремоделирования костей. При усилении возрастной костной резорбции повышается уровень щелочной фосфатазы, остеокальцина в крови, дезоксипиридонолина в моче. При соотнесении с экскрецией креатинина достаточно специфичным является определение кальция в моче, содержание которого повышается при усилении резорбтивных процессов в костной ткани.
- Анализ содержания гормонов. Поскольку постменопаузальный остеопороз патогенетически связан с возрастным гормональным дисбалансом, показательным для диагностики является исследование уровня тиреокальцитонина (ТКТ) и паратирина. При инволютивном нарушении резорбции костей уменьшается концентрация кальцитонина в крови, при этом уровень паратиреоидного гормона остается нормальным или пониженным. Контрольное исследование содержания половых гормонов подтверждает естественную возрастную гипоэстрогению.
Дифференциальная диагностика проводится с сенильным и вторичным остеопорозом, злокачественными костными опухолями и метастазами в кости, миеломной болезнью, фиброзной дисплазией, болезнью Педжета, обычными травматическими переломами, сколиозом, остеохондропатией позвоночника, периферической нейропатией. При необходимости пациентку консультируют ортопед, травматолог, эндокринолог.

КТ таза. Выраженное разрежение трабекулярной структуры и жировая дегенерация костей таза (слева) у пожилой женщины, справа для сравнения норма у молодого мужчины.
Лечение постменопаузального остеопороза
Основной целью терапии является предотвращение возможных переломов за счет улучшения минерализации и архитектоники костей с одновременным повышением качества жизни пациенток. Для этого применяется комплексная антиостеопоретическая терапия, направленная на различные звенья патогенеза заболевания. Стандартная схема лечения остеопороза, вызванного постменопаузальными изменениями в организме женщины, включает следующие группы препаратов:
- Ингибиторы костной резорбции. Эстрогены, их комбинации с прогестинами или андрогенами предотвращают преждевременное разрушение костей и рекомендуются при сохранении климактерических проявлений в первые годы постменопаузы. При наличии противопоказаний или отказе пациентки от приема половых гормонов возможна их замена фитоэстрогенами, селективными модуляторами эстрогенной активности или рецепторов к эстрогенам. Кроме заместительной гормонотерапии эффект замедления резорбции оказывают кальцитонин, бисфосфонаты, препараты стронция.
- Стимуляторы образования костей. Усилению остеогенеза способствует назначение паратиреоидного гормона, анаболических стероидов, андрогенов, соматотропина, фторидов. Ускоренное ремоделирование костей при применении этих лекарственных средств достигается за счет активации остеобластов, усиления анаболических процессов, стимуляции гидроксилирования. Следует учитывать, что при постменопаузальных расстройствах применение таких препаратов ограничено рядом противопоказаний и возможных осложнений.
- Средства многопланового действия. Минерализация и архитектоника костной ткани улучшается при приеме препаратов кальция, особенно в комбинации с витамином D, что позволяет относить такие средства к категории базовых. Разносторонний эффект на процессы остеогенеза и разрушения костей также оказывают оссеино-гидроксилатный комплекс и флавоновые соединения, которые при минимальной вероятности осложнений эффективно тормозят функцию остеокластов, ответственных за резорбцию и деминерализацию, стимулируя остеобластный остеопоэз.
Результативное лечение остеопороза у женщин постменопаузального возраста невозможно без коррекции образа жизни и диеты. Пожилым больным рекомендованы умеренные физические нагрузки с исключением падений, подъема тяжестей, резких движений. В рацион необходимо добавить продукты, богатые кальцием, — молоко, творог, твердый сыр, бобовые, рыбу, другие морепродукты, отказавшись от злоупотребления кофе и спиртными напитками.
Прогноз и профилактика
Хотя постменопаузальный остеопороз является прогрессирующим заболеванием, регулярное поддерживающее лечение и здоровый образ жизни позволяют существенно уменьшить вероятность переломов. С профилактической целью женщинам в постменопаузе рекомендован прием препаратов кальция, содержащих витамин D, дозированные инсоляции, коррекция диеты, достаточная физическая активность с учетом возрастной нормы, отказ от курения, ограниченное потребление продуктов, содержащих кофеин (кофе, чая, шоколада, колы, энергетиков). При выявлении признаков остеопороза эффективной защитой от нагрузок, провоцирующих переломы, могут стать корсеты и протекторы бедра.
Остеопороз и остеопения у женщин в менопаузе

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 24.04.2020
- Время чтения: 1 mins read
Остеопороз – это системное заболевание, когда процессы распада костной ткани преобладают над процессами восстановления и образования новых костных клеток. Остеопения – это описание состояния костной ткани.
Что такое остеопороз и остеопения. Чем опасен остеопороз
Как и другие органы, кости – это живые ткани, проходящие собственный «круг жизни». За формирование, поддержание и реабсорбцию костной ткани отвечают различные типы костных клеток. В молодом или растущем организме костные клетки создают костную ткань быстрее, чем ткани умирают и реабсорбируются. С возрастом расстановка сил меняется.
У людей с остеопорозом, кости становятся ломкими и хрупкими, поэтому подвержены риску перелома. Патология может быть настолько серьезной, что риск переломов увеличивают незначительные травмы и даже кашель.
Остеопения это не диагноз, а описание состояния костной ткани. Дословно «остеопения» означает «низкая костная масса». Остеопения, если она вообще случается, обычно возникает в возрасте около 50 лет. Точный возраст зависит от того, насколько крепка костная ткань в молодости.
При крепкой и здоровой костной системе остеопения не развивается, и наоборот, при ослабленной она может развиться в более молодом возрасте ещё до наступления менопаузы.
Остеопения обычно не имеет никаких явных симптомов. Это затрудняет диагностику. Если не проведен тест на минеральную плотность костной ткани и патология не лечится, остеопения приведет к остеопорозу.
С возрастом прочность костей уменьшается, следовательно, возрастает риск развития остеопороза. Более подвержены этой болезни женщины, особенно белой и монголоидной расы. Поэтому всем женщинам до наступления менопаузы и после нее рекомендуется принимать профилактические меры против остеопороза, пока кости еще относительно здоровы.
Симптомы остеопороза
Одна из опасностей остеопороза заключается в том, что внешних симптомов, предупреждающих о начале развития этой патологии, нет.

Остеопороз – состояние костей
Через много лет, когда кости уже ослабли, женщина может заметить такие признаки, как боль в спине, уменьшение роста или сутулость. Для большинства пенсионеров первым признаком наличия остеопороза становится перелом, обычно бедренной кости или позвоночника.
Поздние симптомы остеопороза:
- Боль в спине.
- Сгорбленность или сутулость.
- Уменьшение роста с течением времени.
- Неожиданные переломы костей.
При появлении первых симптомов остеопороза, важно как можно раньше обратиться к врачу, чтобы предотвратить дальнейшую потерю костной массы.
Факторы риска развития остеопороза
Есть некоторые факторы риска развития остеопороза. К ним относятся:
- Пол. По некоторым оценкам, приблизительно у одной трети женщин старше 50 лет (часто в постменопаузе) наблюдается остеопоротический перелом. Что касается мужчин: переломы, связанные с остеопорозом регистрируются у каждого пятого.
- Возраст. Когда вы становитесь старше, риск развития остеопороза увеличивается.
- Генетика. Остеопороз считается наследственным заболеванием. Если история семьи показывает, что у близких родственников был диагностирован остеопороз или в анамнезе был перелом бедра, это подвергает вас большему риску развития заболевания.
- Масса тела и рост. Когда скорость обновления костей начинает замедляться более высокому риску развития остеопороза подвергаются невысокие и миниатюрные люди. Это связано с тем, что у них меньше костной массы.
- Расовая принадлежность. Азиатские и белые женщины, как правило, болеют остеопорозом чаще, чем чернокожие и латиноамериканки. Точно не известно, почему так происходит, но, скорее всего, это связано с сочетанием нескольких факторов, включая наследственность, различия в размерах тела, гормональный статус, плотность костной ткани и культурные обычаи, которые могут повлиять на диету и физическую активность.
- Гормоны. Поскольку эстроген оказывает защитное действие на костную ткань, уменьшение эстрогена во время менопаузы может ее ослабить. Это одна из причин, почему женщины страдают от остеопороза чаще, чем мужчины.
Установлены также модифицируемые факторы риска, которые могут способствовать возникновению остеопороза. К ним относятся:
- Лекарственные препараты. Некоторые стероиды увеличивают риск развития остеопороза при длительном приеме. Кортикостероиды, такие как преднизолон, кортизон и гидрокортизон, ослабляют костную ткань, тормозя процесс обновления костей. Также известно, что увеличивают риск развития остеопороза некоторые лекарства, используемые для лечения рака, судорог, рефлюксной болезни желудка и предупреждения отторжения трансплантата.
- Анорексия. Анорексия, еще одно заболевание, чаще встречающееся у женщин, чем у мужчин. В этом случае преднамеренный отказ от еды или потеря аппетита вследствие заболеваний лишает организм питательных веществ и приводит к потере плотности и хрупкости костной ткани.
- Физическая активность. Поднятие тяжестей заставляет тело строить крепкие кости. Люди, которые ведут сидячий образ жизни, как правило, подвергаются большему риску остеопороза.
- Алкоголь и табак. Обе эти вредные привычки повышают риск развития остеопороза.
Патологические состояния, увеличивающие риски развития остеопороза
Риск остеопороза выше у людей, имеющих определенные проблемы со здоровьем, к которым относятся:
- Целиакия (абсолютная непереносимость глютена).
- Воспалительное заболевание кишечника (болезнь Крона или язвенный колит).
- Болезни почек или печени.
- Злокачественное новообразование.
- Системная красная волчанка.
- Множественные миеломы.
- Ревматоидный артрит.
Предотвращение потери костной массы и переломов
Профилактика остеопороза и остеопении может быть абсолютно невозможна для некоторых людей, независимо от их желания. Есть множество неконтролируемых факторов риска, которые увеличивают риски развития этих состояний.
Последствия остеопороза
Снижение риска развития патологии начинается со здорового образа жизни еще в юном возрасте. Если в молодости вы накопили достаточно костной массы, вы можете избежать остеопороза с возрастом. Помочь своим костям оставаться крепкими и избежать переломов в результате остеопороза, можно придерживаясь некоторых правил:
- Избегайте курения.
- Избегайте употребление алкоголя. Прием более двух алкогольных напитков в день нарушает процесс обновления костной и соединительной ткани.
- Получайте достаточное количество добавок кальция и витамина D. Это может быть самым важным, что вы можете сделать для своих костей на любой стадии жизни.
- Соблюдайте осторожность. Это правило применимо ко всем, но требует особого внимания со стороны людей преклонного возраста. Предотвращение падений помогает снизить риск переломов, вызванных остеопорозом.
Проведите проверку безопасности вашего дома на наличие мешающих электрических шнуров, скользящих ковриков и скользких полов. Установите поручни и нескользящие подушки в душе и ванной. Носите удобную обувь с нескользящей подошвой в любое время года, в том числе дома.
Диагностика
Методы постановки диагноза остеопороз включают:
- Сбор анамнеза. Опрос о наличии хронических или других диагностированных заболеваний, времени начала менархе;
- Осмотр. Физический, антропометрия, сравнение полученных антропометрических показателей с данными измерений в молодом возрасте;
- Центральный лучевой метод оценки плотности костной ткани (DEXA);
- Ультразвуковые и периферические лучевые методы диагностики;
- Лабораторные исследования.
- Сканирование плотности кости, также известное как двухэнергетическая рентгеновская абсорбциометрия (DEXA) – быстрый, безболезненный и неинвазивный тест состояния костной ткани.
- Во время процедуры запястье, бедро и позвоночник сканируются с помощью низкоуровневого рентгеновского аппарата. Часто такое обследование не рекомендуется женщинам младше 65 лет.
Периферические тесты
- Более безопасны и доступны скрининговые тесты, также называемые периферическими тестами, которые измеряют плотность кости в нижней части руки – запястье, пальце или пятке. Типы периферических тестов:
- pDXA (периферическая двухэнергетическая рентгеновская абсорбциометрия);
- QUS (количественное ультразвуковое исследование пяточной кости);
- pQCT (периферическая количественная компьютерная томография).
Лабораторные методы исследования на остеопороз
Для диагностики остеопороза необходимы дополнительные исследования, особенно у женщин в пременопаузе и перименопаузе, поскольку распространенность вторичных причин остеопороза в этих группах высока. Эти лабораторные исследования позволяют точно установить вторичные причины остеопороза и оценить состояние организма, подтвердить/исключить сопутствующие заболевания и определить дальнейшую тактику лечения остеопороза.
Для относительно здоровых женщин в постменопаузе, у которых по результатам анамнеза и физического осмотра нет данных, указывающих на заболевание остеопорозом, связанное с патологией, некоторые лабораторные исследования можно исключить. Но основная масса тестов обязательна. Должны проводиться анализы на тиреотропин, полный анализ крови, анализ мочи, биохимическая оценка состояния печени.
| Лабораторный тест | Обоснование/дифференциальный диагноз |
| Сывороточный креатинин | Почечная недостаточность, связанная с вторичным гиперпаратиреозом. |
| Функциональные тесты печени | Внутренние заболевания печени и холестатические расстройства, связанные с многофакторными причинами повышенного риска развития остеопороза. |
| Сывороточный кальций | Увеличение: наблюдается при гиперпаратиреозе. Снижение: при мальабсорбции или дефиците витамина D. |
| Щелочная фосфатаза | Увеличение связано с болезнью кости Педжета, длительной иммобилизацией, острыми переломами и другими заболеваниями костей. |
| Сывороточный фосфор | Уменьшение связано с остеомаляцией. |
| Исследования щитовидной железы (тиреотропин и тироксин) | Гипертиреоз-связанная потеря плотности кости. |
| Скорость седиментации или С-реактивный белок | Может указывать на воспалительный процесс или моноклональную гаммопатию, связанную с потерей костной массы. |
| Полный анализ крови | Оценка злокачественности костного мозга, инфильтративных процессов (анемия, низкий уровень лейкоцитов или низкий уровень тромбоцитов) или мальабсорбции (анемия, микроцитоз или макроцитоз). |
| Выделение кальция с мочой | 24-часовая экскреция кальция с мочой на диете с высоким потреблением кальция проверяет мальабсорбцию и гиперкальциурию – исправимую причину потери костной массы; |
Лечение остеопении и остеопороза
Исходя из результатов обследования состояния костной ткани, наличия/отсутствия заболеваний и вторичных факторов риска, женщине рекомендуется индивидуальный план лечения.
Иногда требуются лишь незначительные изменения в образе жизни, в обязательном порядке рекомендуется диета с употреблением продуктов, содержащих кальций в растворимой форме (молочные и кисломолочные продукты) и микроэлементы (магний, калий, фосфор).
Рекомендуется отказ от вредных привычек (алкоголь и курение выводят кальций).
Группы лекарственных средств для лечения остеопороза:
- Бисфосфонаты;
- Кальцитонин;
- Заместительная гормональная терапия;
- RANK ингибитор лиганда;
- Селективные модуляторы рецепторов эстрогена (SERMs);
- Аналоги паратиреоидного гормона.
Комбинация кальция и витамина D . В качестве базовой терапии, улучшающей метаболизм костной ткани относится назначение препаратов кальция (1000-1200 мг) в сочетании с витамином D (800 МЕ) в суточной дозировке.
Бифосфонаты. К наиболее распространенному фармакологическому методу лечения остеопороза относится применение бисфосфонатов. В эту группу препаратов входят Фосамакс, Акласта и Бонива. Бисфосфонаты можно принимать внутрь (еженедельно или ежемесячно) или внутривенно (ежеквартально или ежегодно).
ЗГТ. Если применение бисфосфонатов невозможно из-за наличия противопоказаний, то еще одним вариантом, который поможет увеличить плотность костной ткани, может быть заместительная гормональная терапия. Эстрогенотерапия не относится к методу лечения остеопороза как такового, но эффективна и рекомендуется женщинам с выраженными симптомами менопаузы и предрасположенностью к заболеваниям костно-мышечной и соединительной ткани, в том числе, остеопорозу.
К сожалению, эстрогенная терапия несет в себе некоторые риски, поэтому дозировка и препараты подбираются индивидуально.
Контроль эффективности фармакологического лечения остеопороза включает ежегодное исследование состояния костной ткани при помощи лабораторных методов и/или центрального сканирования (DEXA) и периферического тестирования.
Постменопаузальный остеопороз (ПМО)
Oстеопороз – заболевание, характеризующееся снижением костной массы и нарушениями микроархитектоники костной ткани, что приводит к повышенному риску переломов.
Остеопороз вызывает системное снижение прочности кости, поэтому переломы возникают даже в результате небольшой травмы или падения.
Переломы являются единственным клиническим проявлением остеопороза, поэтому его часто называют «безмолвным заболеванием».
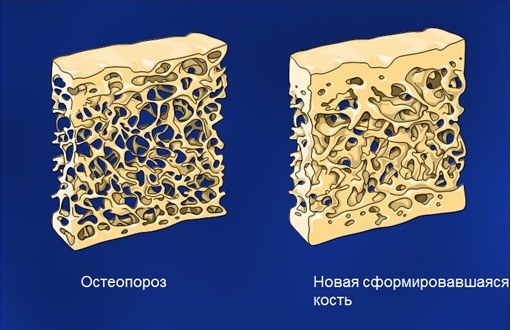
Остеопороз – дословно означает пористые кости, заболевание, при котором происходит потеря костной массы, снижение содержания солей кальция и фосфора (гидроксиапатиты). Кроме этого изменяется микроархитектура кости – изменения каркаса кости. Потеря плотности и качества костной ткани происходит незаметно и постепенно, кости становятся более пористыми и хрупкими, что приводит к повышенному риску возникновения переломов даже при незначительной физической нагрузке (низко травматические переломы).
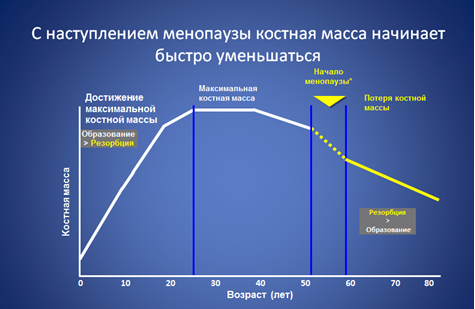
Наши кости – это живая ткань, которая постоянно обновляется. С момента рождения до совершеннолетия, кости растут и укрепляются, при этом преобладают процессы образования костной ткани, достигая своего максимума (пиковая плотность костной ткани) к 20-30 годам. В зрелом возрасте процессы разрушения и восстановления костной массы сбалансированы. В возрасте с 45 лет процессы разрушения костной ткани (резорбция) превалирует над процессами восстановления, в более старшем возрасте этот дисбаланс костеобразования становится более явным, что может приводить к развитию остеопороза.
Конечно же, на процессы восстановления и разрушения костной ткани кроме возраста играют и другие факторы это вес, рост, пол, генетическая предрасположенность, наличие хронических заболеваний, прием определенных лекарственных препаратов.
По мнению большинства экспертов, повышение распространенности остеопороза у женщин по сравнению с мужчинами в возрасте старше 55 лет связано с возникающим дефицитом яичниковых гормонов у женщин в период менопаузального перехода, постменопаузе.
В тоже время нельзя ставить знака равенства между возникновением остеопороза и менопаузой, не все женщины в постменопаузе страдают остеопорозом.
Поскольку дефицит эстрогенов (недостаточная работы яичников) может возникать и у молодых женщин, при таких состояниях, как отсутствие менструаций (аменорея), ранняя менопауза, оперативные вмешательства на яичниках, химиотерапия и лучевая терапия, терапии блокаторами ароматазы при раке молочной железы, все эти пациентки является группой высоко риска развития остеопороза.
Значимым событие в жизни каждой женщины является беременность. Беременность и лактация вызывают физиологические потери костной массы, которые восстанавливаются самостоятельно в течение 1-2 лет после прекращения лактации.
Благодаря современным репродуктивным технологиям, сегодня возможно достижения беременности и у женщин с недостаточной работ яичников. Нетрудно себе представить каково будет состояние костной ткани у этих пациенток, не подготовленных к беременности, во время беременности и лактации. Изменения минерального обмена кальция и фосфора влияет не только на состояние матери, усугубляя исходный дефицит костной массы, но и развитие плода. Тяжелые последствия этих нарушений «Послеродовый остеопороз» – возникновение компрессионных переломов позвоночника в послеродовом периоде.
Остеопороз «немое» заболевание, проявляющееся возникновением низко травматических переломов (позвонков, бедра, лучевой, плечевой, берцовых и тазовых костей…). Низко травматические переломы – это переломы, возникающие при падении с высоты своего роста, или при незначительной физической нагрузке. До возникновения первого перелома, как правило, пациенты не предъявляют каких либо жалоб, в этом и заключается коварность остеопороза.
Нередко недооцененные низко травматические переломы костей лучезапястного и голеностопного суставов, ребер (как следствие остеопороза) в дальнейшем могут приводить к более тяжелым переломам, таким как переломы позвонков и бедренной кости, а это в свою очередь – нарушение активного образа жизни, инвалидизация, зависимость от окружающих.

Отсутствие необходимого лечения при уже возникших остеопоротических переломах позвоночника в 5 раз увеличивают повторные риски переломов позвоночник, риск перелома бедренной кости, переломы периферических костей.
Во всем мире каждая 3 женщина и каждый 5 мужчин старше 55 лет страдают остеопорозом и имеют риск возникновения остеопоротических переломов.
ДИАГНОСТИКА ПОСТМЕНОПАУЗАЛЬНОГО ОСТЕОПОРОЗА
Нет в настоящее время какого либо анализа крови или мочи, позволяющего поставить диагноз остеопороз.
Существуют показатели биохимического исследования крови, уровня витамина D, гормонального обследования (в частности уровень яичниковых гормонов), маркеров процесса костеобразования и разрушения костной ткани, генетические исследования, позволяющие оценить наличие факторов – условий для возникновения остеопороза.
«Золотым» стандартом среди инструментальных методов диагностики остеопороза, принятым международным медицинским сообществом, является двух энергетическая рентгеновская денситометрия (DXA). DXA позволяет оценить костную массу (минеральную плотность костной ткани – МПК) поясничного отдела позвоночника, бедренной кости и лучевой кости.
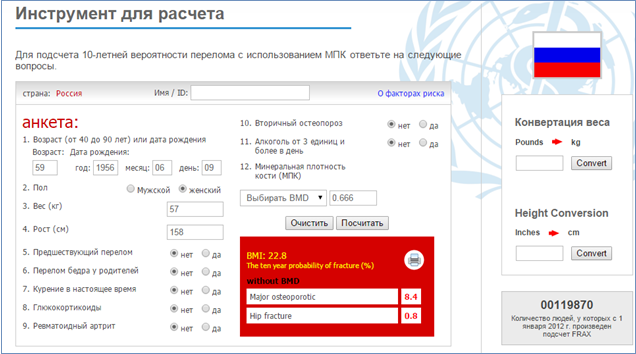
Однако, несмотря на высокую специфичность метода, он обладает недостаточной чувствительностью. Поэтому изначально в обязательном порядке проводится оценка абсолютных факторов риска возникновения основных остеопоротических переломов и переломов шейки бедра, используя калькулятор FRAX.
FRAX оценивает такие факторы риска, как возраст, рос, пол, наличие заболеваний способствующих развитию остеопороза, прием некоторых лекарственных препаратов, возраст наступления менопаузы, наличие предшествующих низко травматических переломов, наличие переломов шейки бедра у родителей. Так же при расчете FRAX может быть использован показатель МПК шейки бедренной кости полученный при проведении DXA.
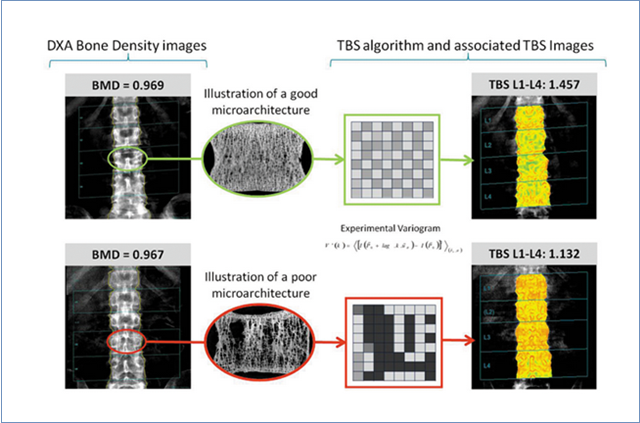
Еще в большей степени повысить чувствительность DXA позволяет методика TBS – трабекулярный костный индекс, оценивающая качественные характеристики костной ткани. Эта методика позволяет дополнительно после проведения DXA выявлять 20-30% пациентов с остеопорозом.
У пациентов с высоким риском возникновения остеопоротических переломов проводится дополнительное рентгенологическое исследования позвоночника с целью исключения наличия компрессионных переломов позвонков.
Важным моментом является не только диагностика остеопороза, но и динамическое наблюдение пациентов получающих антиостеопоротическую терапию. В этом бесспорным помощником является оценка маркеров костеобразования (разрушение и восстановление костной ткани), МПК поясничного отдела позвоночника, бедренной кости и TBS.
МЕТОДЫ ЛЕЧЕНИЯ ПОСТМЕНОПАУЗАЛЬНОГО ОСТЕОПОРОЗА
После постановки диагноза постменопаузального остеопороза или вторичного остеопороза у молодых женщин на фоне гипофункции яичников (отсутствие самостоятельных менструаций, операции на яичниках, химиотерапия, лучевая терапия), исключения вторичного остеопороза обусловленного наличием заболеваний вызывающих развитие остеопороза, врачом определяется вид терапии.
С целью профилактики развития постменопаузального остеопороза, согласно существующим рекомендациям, может быть назначена заместительная гормональная терапия.
У пациенток для лечения остеопороза заместительная гормональная терапия не применяется, но может быть использована в качестве комплексной терапии лечения при наличии других обменно-трофических нарушений климактерического синдрома.
В настоящее время существуют достаточный арсенал эффективных препаратов для лечения остеопороза. Тип терапии определяется индивидуально для каждого пациента с учетом наличия сопутствующих заболеваний.
На фоне проводимого лечения необходимо исключение вредных привычек, обеспечить достаточное потребление кальция с продуктами питания, при необходимости добавляются кальций содержащие препараты, витамин D, дозированная физическая нагрузка.
Лечение остеопороза – длительное, требующее от пациента соблюдений режима приема препаратов и выполнения рекомендаций лечащего врача.
Более 25 летний практический опыт ведения пациенток с постменопаузальным остеопорозом, сотрудников отделения гинекологической эндокринологии, позволило Центру стать ведущим учреждением страны по данной проблематике.
Сотрудники отделения имеют специализированную подготовку по диагностике и лечению остеопороза.
Применяемые методы диагностики и лечения соответствуют международным и Российским стандартам ведения пациенток с остеопорозом.
ВАЖНО: Если у Вас был низко травматический перелом, у кого- то из Ваших родителей был перелом бедренной кости, отсутствуют самостоятельные менструации, раннее наступление менопаузы, вы получаете препараты – блокаторы ароматазы по поводу заболевания молочной железы, Вы старше 55 лет – проверьте Ваши кости, приходите в наш Центр.
ОЦЕНКА СОСТАВА ТЕЛА
При обменных нарушениях (избыточная масса тела, дефицит массы тела), у молодых женщин с нарушениями менструальной функции для подбора лечения, исключения прибавки веса на фоне назначения гормональной терапии в нашем Центре возможно проведение исследование оценки состава тела (BC).
BC позволяет оценить процентное содержание в организме жировой, мышечной и костной ткани, висцерального жира, подкожного жира.
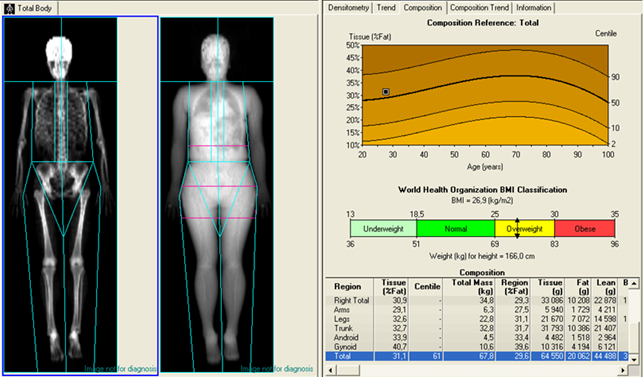
Исследование оценки состава тела позволяет контролировать снижение массы тела по изменения жировой ткани, прибавки мышечной ткани на фоне физических нагрузок.
Метод незаменим при диагностики саркопении – состояния дефицита мышечной массы, у лиц старшего возраста.
Остеопороз у женщин в постменопаузе
Опубликовано в журнале:
« ФАРМАТЕКА » 2014г. О.В. Якушевская
Отделение гинекологической эндокринологии, ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава РФ, Москва
Постменопаузальный остеопороз (ОП) – системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники костной ткани, которые приводят к повышенной хрупкости костей, являясь одной из социальных проблем в развитых странах мира [1]. Частота заболеваемости ОП увеличивается с возрастом, а связанные с ним осложнения растут с увеличением продолжительности жизни. Особенно актуальны эти проблемы для женщин и определяются широкой распространенностью среди населения, многофакторной природой, высокой частотой инвалидизации, а в ряде случаев -смертельными исходами [2]. Поэтому профилактика ОП и снижение риска переломов остаются первостепенной задачей клиницистов.
Ключевые слова: постменопаузальный остеопороз, минеральная плотность костной ткани, селективные модуляторы эстрогеновых рецепторов, тиболон
Остеопороз (ОП) – одна из важных медико-социальных проблем в развитых странах мира. Частота заболеваемости ОП увеличивается с возрастом, а связанные с ним осложнения растут с увеличением продолжительности жизни. Согласно подсчетам, в Российской Федерации ОП страдают 14 млн человек (10 % населения страны), еще 20 млн имеют остеопению. Таким образом, у 34 млн человек присутствует высокий риск переломов [2].
В структуре первичного ОП на долю постменопаузального приходится 85 % случаев заболевания. Женщины в 2 раза чаще имеют риск развития ОП и переломов, связанных с ним. Среди городского населения России 24 % женщин в возрасте 50 лет и старше имеют один остеопоретический перелом. По данным Всемирной организации здравоохранения, средняя продолжительность жизни женщин в России составляет 72 года. Около 20 лет приходится на период постменопаузы, т.е. на время высокого риска развития ОП и риска остеопоротических переломов, главным образом костей запястья, ребер, тел позвонков, шейки бедренной кости [2].
Прогрессирование ОП характеризуется значительным снижением минеральной плотности костной ткани (МПКТ), нарушением ее микроархитектоники, что приводит к повышению хрупкости костей и риску низкотравматичных переломов. Потеря плотности кости происходит постепенно, скрыто и часто диагностируется уже после случившихся переломов, что и дало основание назвать ОП «безмолвной эпидемией» [3].
Как показали эпидемиологические исследования, в течение первых 5 лет после наступления менопаузы потеря костной массы у женщин может составить до 30 %. Так, для 50-летней женщины риск перелома позвоночника составляет в среднем 15,5 %, шейки бедра -17,5 %, костей запястья – 16,0 %. Старение популяции приводит к непропорциональному увеличению числа переломов. Согласно прогнозу, в Российской Федерации 1 из 3 женщин после 80 лет на фоне ОП получит перелом шейки бедра. Как показали международные исследования, у женщин в возрасте старше 65 лет, остеопоротические переломы шейки бедра составляют 90 % [3].
Профилактика любого заболевания эффективнее, надежнее и дешевле лечения и предусматривает первоочередное воздействие на центральное звено его патогенеза. При постменопаузальном ОП в основе наблюдаемых изменений в костях лежит ослабление костнопротективного эффекта половых стероидов на фоне их абсолютной недостаточности. Это предполагает, что заместительную гормональную терапию (ЗГТ) препаратами женских половых стероидов вполне обоснованно можно рассматривать как «первую линию» лечебных воздействий, направленных на обеспечение сохранности МПКТ в условиях гипоэстрогении. Установлено, что эстрогены – эффективные антирезорбтивные средства, позволяющие сохранять архитектуру костных трабекул в постменопаузе [4].
Селективные модуляторы эстрогеновых рецепторов (СМЭР) действуют как агонисты эстрогенов в одних органах (сердечно-сосудистая система, костная ткань) и как антагонисты – в других (матка, молочная железа). В настоящее время собраны убедительные данные, согласно которым селективные модуляторы эстрогеновых рецепторов служат эффективным и перспективным препаратом профилактики ОП, возможно, сердечно-сосудистых заболеваний у женщин в менопаузе. Использование СМЭР позволяет расширять профилактические возможности женщин, имеющих какие-либо противопоказания к назначению классической ЗГТ [5].
Тиболон претерпел длительный этап испытаний длиною в 25 лет, прежде чем его одобрили в качестве коррекции эстрогендефицитных состояний. Тиболон впервые синтезировали в 1964 г. в Нидерландах (Ливиал, Organon), а в настоящее время он успешно синтезируется в Чешской Республике (Ледибон, ZENTIVA). Препарат зарегистрирован в 91 стране для лечения климактерического синдрома и в 55 странах для профилактики ОП. На этапе доклинических и клинических испытаний было выявлено, что тиболон обладает эстрогенной, прогестагенной и андрогенной активностью. Однако было трудно объяснить отсутствие его стимулирующего эстрогенного влияния на молочные железы и эндометрий. В результате интенсивного изучения механизма действия тиболона и его метаболитов установлена их тканеселективная активность в различных органах и тканях, на основании которой препарат отнесен к группе СМЭР [6].
По химической структуре тиболон является 19-норстероидным прогестином. Введение 7α-метильной группы в норэтинодрел, который имеет двойную связь в положении 5-10, резко изменило его прогестагенные свойства и способствовало развитию эстрогенных. Биопробы показали, что тиболон может имитировать активность всех трех половых стероидов. Эстрогенное и анаболическое влияние тиболона поддерживает положительный баланс кальция в организме, и данное свойство стало отправной точкой для последующих исследований, касающихся метаболических заболеваний костей [7].
В 1979 г. проведены детальные исследования метаболитов тиболона. Осуществить радиоиммунологический анализ in vitro/in vivo не представлялось возможным, т.к. тиболон очень быстро подвергался метаболизму. Исследование «меченого» тиболона продемонстрировало образование его трех основных метаболитов. После приема внутрь тиболон под влиянием ферментов 3α- и 3β-гидроксистероиддегидрогеназ и изoмеразы в печени и тонком кишечнике превращается в три биологически активных метаболита: 3α- и 3β-гидрокси (3α- и 3β-ОН) метаболиты и Δ4-изомер.
Гидроксильные метаболиты тиболона исключительно связываются с эстрогеновыми рецепторами, а третий, Δ4-изомер, связывается с рецепторами к прогестерону и рецепторами к андрогенам. Оба 3-гидроксиметаболита являются агонистами эстрогеновых рецепторов у человека. Хотя эти метаболиты слабее эстрадиола, но эстрогенный ответ объясняется их высоким уровнем в кровотоке. Оба метаболита, обладающих эстрогенной активностью, быстро попадают в кровоток, при этом уровень 3α-ОН метаболита в 3 раза выше, чем 3β-ОН. Период полураспада 3α-ОН и 3β-ОН метаболитов в кровотоке составляет 7-8 часов, но они могут определяться в кровотоке в низких концентрациях в течение 5 дней. 3α-ОН и 3β-ОН метаболиты обладают большим родством с α-эстрогеновыми рецепторами (α-ER), чем с β-ER [8, 9].
Таким образом, ассоциированная активность трех метаболитов определяет гормональное влияние тиболона на органы-мишени. Около 80 % метаболитов тиболона существует в кровотоке в неактивных моно- и дисульфатных формах, которые под влиянием фермента сульфатазы могут превращаться в активные на локальном тканевом уровне [9].
Первое многоцентровое исследование тиболона в лечении ОП стартовало в 1971 г., но его не удалость закончить из-за отсутствия стандартизации измерения МПКТ в различных центрах и получения различных результатов. В 1973 г. было начато новое исследование. Изначально участницы исследования получали более высокие дозы тиболона (2,5 мг 2 раза в сутки). Через 3 месяца доза была снижена до 1,25 мг 2 раза в сутки. Использование тиболона постменопаузальными женщинами с ОП в различных дозах в течение 2 лет не сопровождалось потерей МПКТ по сравнению с группой плацебо. При исследовании меньшей дозы существенно сокращалась выраженность климактерических проявлений и улучшение настроения. При анализе биоптатов эндометрия женщин, использующих тиболон, гиперплазии выявлено не было [10].
В 1982 г. с помощью биопроб анализировался гормональный профиль тиболона. Эстрогеновая активность -такая же, как у этинилэстрадиола, составила 10 %, прогестероновая, как у норэтистерона, – 12 %, анроген-ная, как у метилтестостерона, – 2 %. Относительная связывающая аффинность для Δ4-метаболита составила 30 % по сравнению с дигидротестостероном, обладающим данным свойством на 100 %. Присоединение 7α-метильной группы к структуре тиболона привело к увеличению эстрогенных свойств и уменьшению прогестероновой активности по сравнению с норэтинодрелом [11].
Тиболон проявляет эстрогенное влияние и на костную ткань, связываясь с эстрогеновыми рецепторами. В своих исследованиях это подтвердили Ederveen и соавт. в 2001 г. [12].
J.C. Gallagher и соавт. в своем исследовании с участием 770 женщин попытались определить минимально эффективные дозы тиболона в профилактике потери МПКТ у женщин в постменопаузе. На протяжении 2 лет было изучено несколько доз тиболона (0,3; 0,625; 1,25; 2,5). Все дозы (кроме 0,3 мг в сутки) прогрессивно увеличивали МПКТ в поясничном отделе позвоночника и общем бедре на протяжении всего периода наблюдения. При использовании дозы в 0,3 мг динамики изменения МПКТ в общем бедре не регистрировали. Установлено, что разницы средних процентных изменений МПКТ в сопоставлении с исходным уровнем в позвоночнике и всей бедренной кости были статистически значимы (p Достоверное увеличение МПКТ шейки бедра отмечено начиная с дозы 1,25 мг/сут [13]. Основные результаты продемонстрированы на рисунке.
В длительном открытом нерандомизированном исследовании женщин в постменопаузе изучалась реакция МПКТ на тиболон по сравнению с плацебо. Результаты подтвердили, что спустя 8 лет с момента начала терапии в основной группе имело место значительное увеличение МПКТ как в поясничном отделе позвоночника (4,1 %), так и в шейке бедренной кости (4,6 %; р Таблица.
Влияние тиболона 1,25 мг/сут на риск возникновения переломов позвоночника
| Переломы | Частота (число случаев/1000 женщин-лет) | Относительный риск | 95 % доверительный интервал |
Достоверность тиболон (n = 2059) плацебо (n = 2087) (p) |
|
|---|---|---|---|---|---|
| тиболон (n = 2059) |
плацебо (n = 2087) |
||||
| Переломы позвонков | 70 (10,9) | 126 (19,6) | 0,55 | [0,41; 0,74] | |
| Другие переломы | 122 (19,5) | 166 (26,3) | 0,74 | [0,58; 0,93] | 0,011 |
Таким образом, изучение кинетики и механизма действия тиболона и его метаболитов показало сложность его влияния в различных органах и тканях. С одной стороны, по химической структуре он относится к гормонам и, следовательно, используется как гормонотерапия при эстрогендефицитных состояниях. С другой – наряду непосредственно с гормональным воздействием тиболон оказывает влияние через ферментную регуляцию в отдельно взятых органах (молочной железе, эндометриий, костной ткани и др.). На основании многочисленных исследований как на животных, так и на человеке тиболон был отнесен к достоверно эффективным препаратам, которые могут применяться с заместительной целью женщинами в период постменопаузы, восполняя уровень эстрогенов и предотвращая потерю МПКТ после менопаузы или овариэктомии.
Рис. Изменения МПК (%) в поясничном отделе позвоночника и проксимальном отделе бедренной кости
после 2 лет терапии различными дозами тиболона по сравнению с плацебо [13]
ЛИТЕРАТУРА
1. Лесняк О.М. Аудит состояния проблемы остеопороза в странах восточной Европы и центральной Азии 2010. Остеопороз и остеопения. 2011;2:3-6.
2. Лесняк О.М., Беневоленская Л. И. Клинические рекомендации «Остеопороз. Диагностика, профилактика и лечение». М., 2009.
3. Михайлов Е.Е., Беневоленская Л.И. Эпидемиология остеопороза и переломов. В кн. «Руководство по остеопорозу». М., 2003. С. 10-53.
4. Сметник В.П., Кулаков В.И. Руководство по климактерию. М., 2001.
5. Overbeek G.A., van Vliet N.P., van der Vies J., et al. The infl uence of steroids on the skeleton. Arch Int Pharmacodyn Ther. 1969;182:420.
6. Sandker G.W., Vos R.M., Delbressine LP. Metabolism of three pharmacologically active drugs in isolated human and fat hepatocytes: analysis of interspecies variability and comparison with metabolism in vivo. Xenobiotica. 1994;24:143-55.
7. Tax L, Goorissen E.M., Kicovic P.M. Clinical profile of Org OD14. Maturitas. 1987(Suppl 1):3-13.
8. Vos R.M., Krebbers S.F., Verhoeven C.H., Delbressine LP. The in vivo human metabolism of tibolone. Drug Metab. Dispos. 2002;3:106-12.
9. Markiewicz L, Gurpide E. In vitro evaluation of estrogenic, estrogen antagonistic and proges-tagenic effects of a steroidal drug (Org OD-14) and its metabolites on human endometrium. J. Steroid Biochem. 1990;35:535-41.
10. Lindsay R., Hart D.M., Kraszewski A. Prospective doubleblind trial of synthetic steroid (Org OD 14) for preventing postmenopausal osteoporosis. Br. Med. J. 1980;280:1207-09.
11. de Gooyer M.E., Deckers G.H., Schoonen W.G., et al. Receptor profi ling and endocrine interactions of tibolone. Steroids. 2003;68:21-30.
12. Ederveen A.G., Kloosterboer H.J. Tibolone exerts its protective effect on trabecular bone loss through the estrogen receptor. J. Bone Miner Res. 2001;16:1651-57.
13. Gallagher J. C, Baylink DJ., Freeman R., McClung M. Prevention of bone loss with tibolone in postmenopausal women: results of two randomized, double-blind, placebo-controlled, dose- fi nding studies. J. Clin. Endocrinol. Metab. 2001;86:4717-26.
14. Rymer J., Robinson J., Fogelman I. Effects of 8 years of treatment with tibolone 2.5 mg daily on postmenopausal bone loss. Osteoporos Int. 2001;12:478-83.
15. Cummings S.R., Ettinger B., Delmas P.D. The effects of tibolone in older postmenopausal women. N. Engl. J. Med. 2008;359:697-708.
Постменопаузальный остеопороз: потеря костной массы скелета
Постменопаузальный остеопороз – потеря костной массы скелета, обусловленная нехваткой половых гормонов. Развивается у женщин в период климакса, опасен внезапными переломами позвонков или трубчатых костей. Требует медикаментозного лечения, отказа от вредны


ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ

Мягко, приятно, нас не боятся дети



ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ

Мягко, приятно, нас не боятся дети


Остеопороз – системное заболевание костных тканей скелета, характеризующееся потерей костной массы и нарушением их архитектоники. Приводит к постепенному снижению прочности костей и возрастающему риску внезапных переломов. Постменопаузальный остеопороз имеет многофакторную этиологию, прежде всего это дефицит половых гормонов (в частности эстрогена, производимого яичниками).
Постменопаузальный остеопороз составляет примерно 85% всех случаев заболевания и отмечается у женщин в возрасте от 50 лет и старше. Чаще всего патология диагностируется уже после факта получения перелома (тел позвонков, костей скелета) и ведет к инвалидности или возрастающей смертности женщин пожилого возраста.
Механизм влияния эстрогенов на костные ткани до конца еще не изучен. Однако известно, что эти гормоны вместе со сбалансированным полноценным питанием и адекватными физическими нагрузками входят в число главных факторов, определяющих коэффициент массы и качество костей скелета. Пиковое значение костной массы набирается человеком примерно между 20-30 годами, после 45 лет у женщин начинается постепенное снижение продукции половых гормонов, а, следовательно, и вымывание кальция из кости.
Предпосылки к возникновению заболевания
Основной причиной развития заболевания является дефицит гормонов, наступающий у женщин в период постменопаузы. Уже в первые 5 лет ежегодная потеря костной массы скелета составляет примерно 3-5%. Возрастное нарушение обменных процессов приводит к увеличению скорости ремоделирования костей остеокластами (клетки, отвечающие за разрушение костных тканей). Повышенная резорбция тканей не компенсируется необходимым объемом костеобразования (проводимого остеобластами), что приводит к стремительной и необратимой потере плотности кости.
Кроме того в зону риска входят женщины:
- с врожденной низкой минеральной плотностью костей скелета;
- возраст которых старше 65 лет;
- европеоидной расы;
- с генетической предрасположенностью к заболеванию;
- длительно принимающие глюкокортикоиды;
- с очень низкой массой тела или наоборот, чрезмерно избыточной;
- злоупотребляющие никотином, алкоголем и продуктами, содержащими кофеин;
- с онкологическими заболеваниями;
- перенесшие в молодости операцию по удалению яичников;
- не получающие достаточных физических нагрузок или наоборот, занятые тяжелым физическим трудом;
- рацион которых содержит недостаточное количество кальция и/или витамина D.
Симптоматика
У большинства женщин развитие остеопороза протекает практически бессимптомно, так как приходится на период климакса, когда возрастные изменения охватывают практически весь организм (нервную систему, сердечнососудистую, эндокринную). Женщины ощущают приливы жара или наоборот постоянно мерзнут, становятся раздражительными. Учащенное сердцебиение, головные боли или головокружения, бессонница, резкое прибавление или потеря веса затмевают проявления постменопаузального остеопороза.
Основными жалобами, непосредственно относящимися к заболеванию, становятся боли в поясничной области и крестце, возникающими после длительного пребывания на ногах или при усилении привычных физических нагрузок. Также общая слабость, особенно в конце дня, быстрая утомляемость, тяжесть и болевые ощущения в плечевом поясе и между лопаток, что требует отдыха в середине дня в лежачем положении.
Параллельно происходит нарастание затрудненного дыхания после нагрузок, ссутуливание. Болевые синдромы в позвоночнике и тазовых костях усиливаются по мере прогрессирования болезни, становятся хроническими и не оставляют даже в состоянии покоя. При поднятии тяжести могут возникать микротрещины трабекул (костных перегородок губчатого вещества).
Следующим этапом развития недуга становятся внезапные переломы тел позвонков (как правило, грудного и поясничного сегментов), дистального отдела лучевых костей рук, лодыжек, проксимального сегмента бедренных костей (шейка бедра) даже при незначительном механическом воздействии или падении. Причем компрессионный перелом единичного позвонка может не отзываться сильной болью, а проявить себя только когда в патологию вовлекутся смежные сочленения.
Постепенная клиновидная деформация передних стенок позвонков, их сплющивание, ослабление мышечного корсета спины формирует нарушение осанки (кифоз, сутулость) и постепенное снижение роста. Пациентки с множественными компрессионными переломами позвоночника теряют трудоспособность, возможность самостоятельно себя обслуживать, становятся инвалидами. Критической отметкой снижения роста считается 2 см в течение одного года. Потеря 4 см на протяжении всей жизни вносит пациентку в группу риска развития остеопороза.
Диагностика заболевания
Учитывая всевозрастающие показатели заболеваемости и увеличение случаев перелома всем женщинам старше 45-50 лет (а при ранней менопаузе можно и раньше) желательно 1 раз в 2 года сдавать денситометрию (исследование, определяющее минеральную плотность костных тканей).
При подозрении на развитие остеопороза назначается рентгенограмма позвоночника (в прямой и боковой проекции для выявления компрессионных переломов), тазобедренных костей и предплечий. Для уточнения некоторых моментов может понадобиться МРТ или КТ-диагностирование. Из аппаратных исследований могут назначаться: УЗИ внутренних и половых органов, молочных желез, маммография. При необходимости проводится и генетическое исследование.
Лабораторные анализы состоят из: общего анализа крови и мочи, биохимического анализа крови на содержание в ней кальция, фосфора, калия и прочих микроэлементов. Далее определяется содержание кальция в суточной моче, половых гормонов в крови, гемостаза и определяются биохимические маркеры костного метаболизма. Оценка резорбции и костеобразования тканей позволяет выявить пациенток с ускоренным метаболизмом кости, определить эффективность лечения, выявить больных резистентных (нечувствительных) к терапии.
Дифференциальная диагностика проводится для установления или исключения вторичных факторов развития заболевания. Это могут быть:
- заболевания эндокринной системы;
- заболевания желудочно-кишечного тракта, которые влияют на усвоение кальция в кишечнике;
- хроническая почечная недостаточность;
- длительный прием лекарств, негативно влияющих на минеральный состав костей;
- длительная иммобилизация (обездвиживание);
- избыточное потребление продуктов, содержащих кофеин, курение, алкоголь.
Лечение постменопаузального остеопороза
Как правило, пациентки обращаются в клиники лечения остеопороза уже после получения перелома позвонков (когда боли в спине становятся невыносимыми) или других костей скелета, что значительно усложняет лечение. Госпитализация предлагается только лицам с переломами, остальные больные могут проходить лечение в домашних условиях. Прежде всего, лечение направленно на увеличение минеральной плотности кости или стабилизацию состояния здоровья, а также улучшение качества жизни (устранение болевых синдромов, возвращение двигательных возможностей и пр.).
- обязательное применение препаратов, содержащих кальций (до 1000 мг) и витамин D (600-800 МЕ);
- средства, снижающие костную резорбцию (бисфосфонаты, кальцитонин и др.);
- средства, усиливающие ремоделирование костей (паратгормоны, анаболические стероиды, андроген);
- при необходимости назначается гормональная терапия эстрогенами, андрогенами или прогестагенами;
- обезболивающие препараты для снятия болевых синдромов;
- вещества, снимающие мышечные спазмы и напряжение (миорелаксанты).
Лечение остеопороза – процесс длительный, требующий от пациенток определенной выдержки и пересмотра всего образа жизни. Это отказ от вредных привычек, физическая активность, длительное пребывание на свежем воздухе и солнце, диета, при необходимости ношение корсета или протекторов бедра, избегание резких движений, поднятия тяжестей и падений.
Хирургическое лечение постменопаузального остеопороза проводят редко. Его предлагают если компрессионные переломы позвонков травмируют спинной мозг, нервные корешки, кровеносные магистрали, что негативно сказывается на работе внутренних органов или на общем состоянии здоровья пациентки. В некоторых случаях оперирования требует и перелом шейки бедра.
Остеопороз
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Остеопороз: причины появления, симптомы, диагностика и способы лечения.
Определение
Остеопороз – это метаболическое заболевание костей, характеризующееся снижением их плотности в результате уменьшения количества костного вещества или недостаточного его обызвествления.
В кости появляются «дыры», из-за чего она становится хрупкой и склонной к повреждению даже при незначительном механическом воздействии
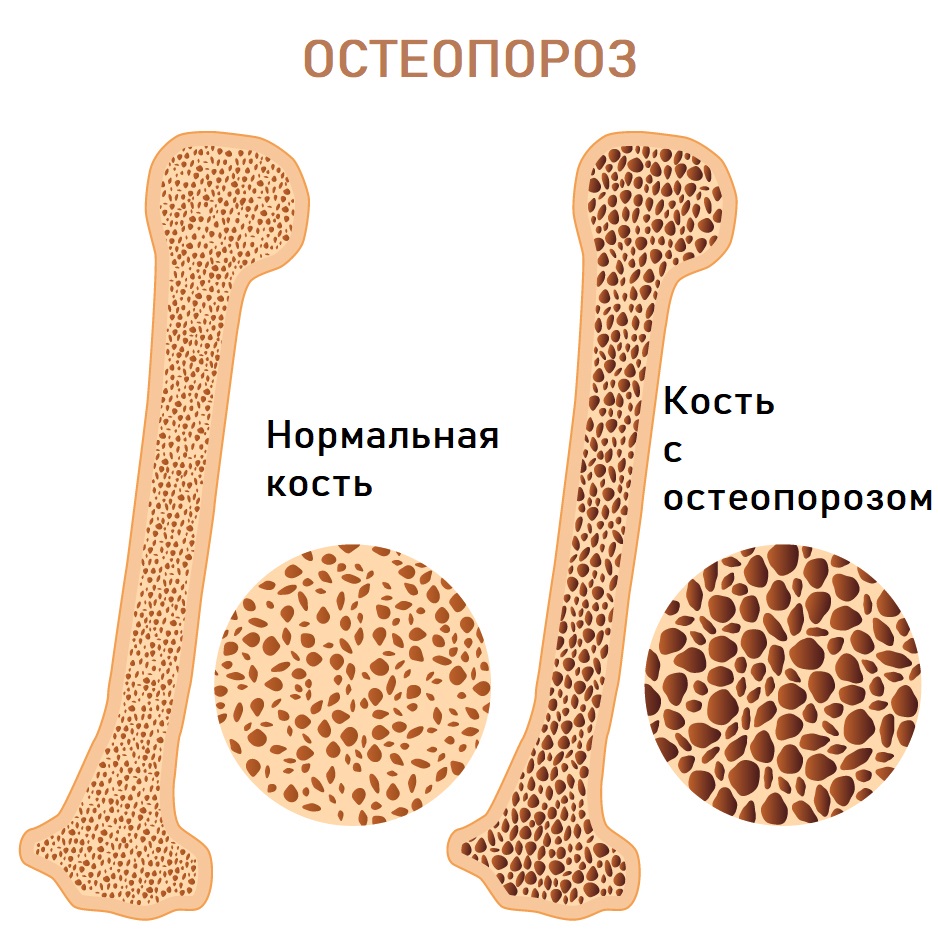
Остеопороз – очень распространенное заболевание. В России им страдают около 14 млн человек, причем у женщин остеопороз встречается чаще, чем у мужчин. Опасность остеопороза состоит в том, что заболевание не имеет характерных симптомов, которые указывали бы на начало процесса, но зная определенные факторы риска и соблюдая профилактические меры, можно предотвратить его или облегчить течение.
Причины появления остеопороза
В костях постоянно происходят два противоположных процесса – формирование и разрушение (костная резорбция) костной ткани.
Для эффективного образования новой костной ткани требуется строительный материал, в синтезе которого принимают участие многие органы и системы организма: через желудочно-кишечный тракт в организм поступают белки, углеводы, жиры (основной строительный материал и источник энергии), минеральные вещества, такие как кальций и фосфор, которые придают костям плотность. Эндокринная система участвует в регуляции обмена веществ и интенсивности процессов образования и разрушения костной ткани. В почках образуются активные витамины, которые помогают в строительстве костей. Благодаря мышцам ускоряется рост костей.
При нарушениях работы хотя бы одного звена этой сложной системы происходит нарушение баланса образования костной ткани и ее разрушения.
К развитию остеопороза могут привести многие заболевания.
Все факторы риска развития остеопороза принято разделять на модифицируемые (которые можно контролировать) и немодифицируемые (те, повлиять на которые нельзя).
К модифицируемым факторам риска относятся:
- табакокурение;
- недостаточное потребление кальция;
- дефицит витамина D;
- злоупотребление алкоголем;
- прием глюкокортикостероидов более трех месяцев;
- низкая физическая активность;
- длительная иммобилизация (неподвижность).
- возраст старше 65 лет;
- женский пол;
- европеоидную расу;
- предшествующие переломы;
- низкую минеральную плотность костей;
- склонность к падениям (из-за нарушений зрения, сна, немощности, низкой физической активности или приема препаратов, вызывающих головокружение);
- наследственность (семейный анамнез остеопороза);
- гипогонадизм у мужчин и женщин (снижение выработки половых гормонов);
- снижение функции почек;
- недостаточную массу тела.
Для пациентов, у которых есть один или несколько факторов риска развития остеопороза, проводят специально разработанный скрининг, благодаря которому можно диагностировать заболевание на раннем этапе.
Классификация остеопороза
Существует множество классификаций остеопороза. В настоящее время используют классификацию, основанную на причине развития остеопороза.
Выделяют группу первичного остеопороза, который подразделяется на:
- Постменопаузальный остеопороз (I тип).
- Сенильный (старческий) остеопороз (II тип).
- Ювенильный остеопороз (встречается у детей).
- Идиопатический остеопороз (причина которого не может быть установлена).
- эндокринной системы – болезнь или синдром Иценко–Кушинга (усиленная выработка гормонов надпочечников), тиреотоксикоз (гиперфункция щитовидной железы), гипогонадизм, гиперпаратиреоз (увеличенная выработка гормонов паращитовидных желез), инсулинозависимый сахарный диабет, полигландулярная (когда в процесс вовлечены несколько желез внутренней секреции) эндокринная недостаточность;
- ревматических – системная красная волчанка, ревматоидный артрит, анкилозирующий спондилоартрит;
- органов желудочно-кишечного тракта – хронические заболевания печени и поджелудочной железы, синдром мальабсорбции (снижение способности всасывания в кишечнике), состояние после резекции (удаления части) желудка и кишечника;
- почек – хроническая почечная недостаточность, почечный канальцевый ацидоз;
- крови – лейкозы и лимфомы, миеломная болезнь (заболевания, при которых увеличивается количество тех или иных клеток крови, в том числе злокачественные опухоли крови), гемофилия (наследственная патология, характеризующаяся нарушением работы свертывающей системы крови), системный мастоцитоз (увеличение количества тучных клеток – одного из типа белых клеток крови);
- генетических нарушений (синдром Марфана, несовершенный остеогенез);
- вторичный остеопороз, развившийся на фоне других состояний, например, алкоголизма, нарушения питания, длительной иммобилизации, хронических обструктивных заболеваний легких, трансплантации органов, овариэктомии (удаления яичников);
- вторичный остеопороз, развившийся на фоне приема лекарственных средств.
Для остеопороза не характерны явные клинические проявления до момента травмы.
Таким образом, можно сказать, что остеопороз проявляется своим осложнением, то есть переломом костей в ответ даже на незначительное внешнее воздействие.
После перелома появляются типичные симптомы: боль, отек, покраснение и нарушение функции той части тела, где случился перелом.
В некоторых случаях переломы могут происходить незаметно для человека – например, компрессионные переломы позвонков, возникающие под воздействием тяжести собственного тела, когда позвонки, пораженные остеопорозом, не справляются с нагрузкой и «сплющиваются».
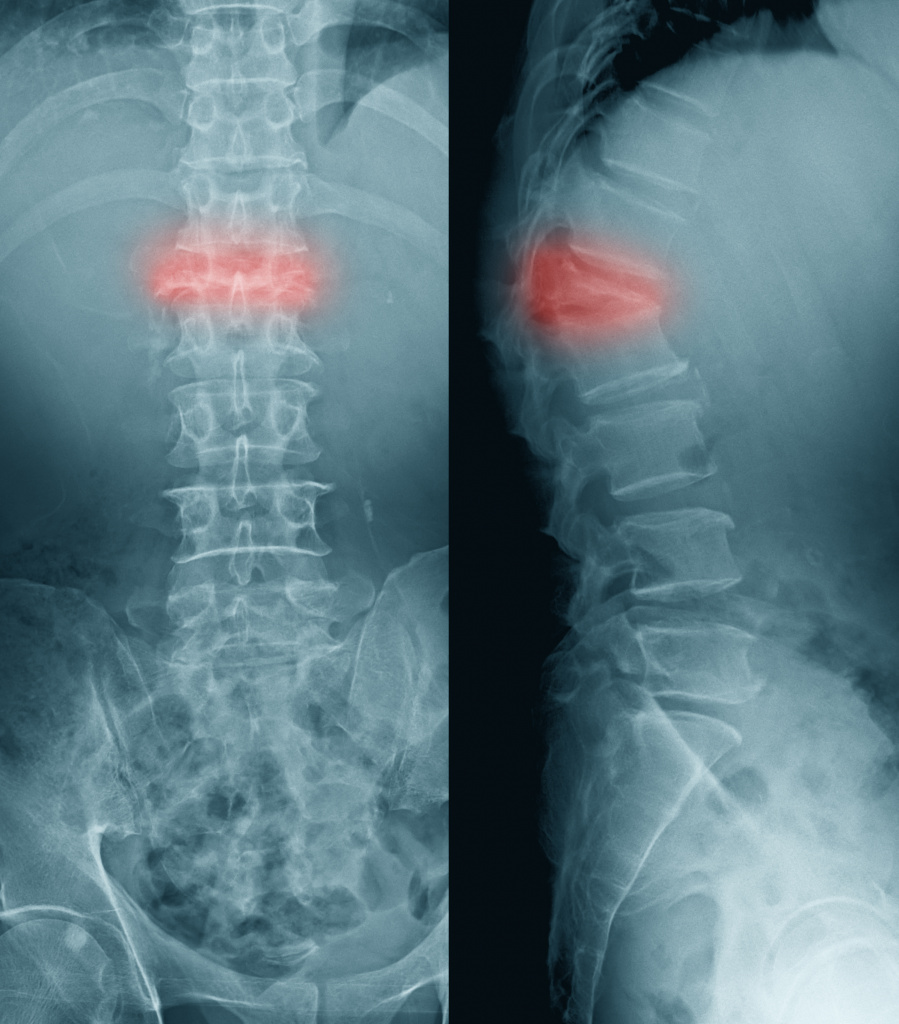
Компрессионный перелом позвоночника
Заподозрить перелом позвонков при остеопорозе можно, если:
- острая боль, иррадиирущая по типу корешковой боли в грудную клетку, брюшную полость или бедро, резко ограничивающая движения, усиливающаяся при минимальных движениях;
- боль в спине появилась после падения с высоты собственного роста или после подъема тяжелых предметов, которая не проходит после приема нестероидных противовоспалительных препаратов;
- уменьшился рост;
- чувство усталости в спине после вынужденного пребывания в одном положении или ходьбы;
- «ощущение тяжести» между лопатками.
Физикальное обследование включает:
- измерение роста пациента (уменьшение роста на 2 см и более за 1-3 года или на 4 см и более по сравнению с возрастом в 25 лет отражает снижение высоты позвонков при компрессии);
- измерение расстояния между затылком и стеной при измерении роста (если это расстояние составляет более 5см, то можно говорить о грудном кифозе);
- измерение расстояния между нижними ребрами и крылом подвздошной кости (если это расстояние составляет ширину 2-х пальцев и менее, то можно говорить об укорочении позвоночного столба из-за компрессий позвонков).
В ходе лабораторной и инструментальной диагностики исследуют причину остеопороза: носит ли заболевание первичный характер или вызвано метаболическими расстройствами.
Кроме того, проводится поиск осложнений остеопороза. Врач назначает комплекс исследований, который может включать:
-
клинический анализ крови (определение уровня гемоглобина, эритроцитов, тромбоцитов, лейкоцитов с подсчетом лейкоцитарной формулы);
Одно из основных лабораторных исследований для количественной и качественной оценки всех классов форменных элементов крови. Включает цитологическое исследование мазка крови для подсчета процентного содержания разновидностей лейкоцитов и определение скорости оседания эритроцитов.


