Противоэпилептические препараты
Выявить причины эпи-приступов; исключить провоцирующие факторы; установить тип припадков и определить тип эпилепсии.
Для лечения используют 2 способа: консервативный и хирургический. Консервативный разделяют на: патогенетическую и симптоматическую.
Симптоматическая терапия: назначение противосудорожных препаратов, эпизодическое назначение психотропных средств, которые купируют те или иные приходящие нарушения. Лечение противоэпилептическими препаратами можно считать и патогенетическим.
Диагностика эпилепсии, как болезни предусматривает в обязательном порядке прием противоэпилептических препаратов – «принятие решения о назначении противоэпилептических средств».
Начальные дозы
Время стабилизации
Рекомендуемое назначение АЭП:
Препараты, назначаемые с эффективной дозы: вальпроевая к-та, фенитоин, оксикарбазепин, габапентин, левитирацетам.
Препараты, нуждающиеся в титровании до эффективной дозы: карбамазепин, ламотриджин, топирамид, тиаграбин, зонисамид.
Выбор ПЭП в зависимости от типа приступа:
Тип припадка
Препарат выбора
Альтернативный препарат
Фокальные приступы:
— простой фокальный
— сложный фокальный
— вторично генерализованный
— генерализованные приступы
— тонико-клонические
— тонические
— клонические
— атипичные абсансы
— атонические
— миоклонические
Препараты первого выбора:
Барбитураты (фенобарбитал, фалилепсин)
Иминостильбены (карбамазепин=финлепсин, тегретол)
Вальпроаты: Na: ацедипрол (депакин). Са: конфульсофин. Mg: дипромал.
Новые противоэпилептические с-ва различных химических групп: вигабатрин, ламотриджин, фелбамат, габапентин, стирипентол.
В консервативном лечении больных эпилепсией выделяют три этапа:
1. выбор наиболее эффективного и хорошо переносимого способа лечения и его использование с целью ликвидации пароксизмов при сохранении хорошего соматического и психического состояния.
2. становление терапевтической ремиссии, ей закрепление и предупреждение обострений.
3. проверка стойкости ремиссии со снижением дозы медикаментов до минимума или полной отменой приема ПЭП.
Общие принципы терапии антипароксизмальными препаратами:
1. Длительность; 2. Непрерывность приема; 3. Постепенное наращивание дозировок; 4. Индивидуализация лечения; 5. Комплексный характер терапии.
При лечении ПЭП:
Лечение начинают с небольшой дозы ПЭП из группы препаратов выбора. Дозу увеличивают при сохранении припадков и отсутствии побочных эффектов.
При сохранении припадков диагноз и этиологию эпилепсии уточняют.
После этого можно использовать альтернативный препарат, дозу которого доводят до оптимальной, а первый препарат отменяют.
Доза второго препарата, принимаемого изолированно, доводится до оптимального уровня, так же, как и доза первого.
При продолжении припадков, используют комбинацию 2-х препаратов выбора.
При неэффективности 2-х препаратов выбора продолжают прием того препарата, который был более эффективен при меньших побочных эффектах, и назначают альтернативный ПЭП.
При неэффективности альтернативного препарата рекомендуют отменить начальный препарат.
Если и после этого припадки продолжаются, можно использовать другие ПЭП.
Если все выше не действенно, рекомендовано хирургическое лечение в специализированном центре.
Стратегия замены ПЭП в случае их неэффективности:
На фоне приема 1-2 противосудорожных препаратов провести: дезинтоксикационную терапию (гемосорбция, плазмофорез); десенсибилизирующую терапию с включение глюкокортикоидов (дексаметазон); решить вопрос о целесообразности назначения другого противоэпилептического препарата; замена препарата производится постепенно: одну таблетку отменяют-другую назначают.
Реабилитация больных эпилепсией.
Реабилитационные меры разнообразны и направлены на восстановление социального и трудового статуса больного. Правильный выбор профессии и рода занятий с учетом индивидуальных особенностей и интересов или учебного заведения при стремлении и возможности продолжать образование, создание благоприятного психологического климата в семье и коллективе, занятия доступными для больного видами спорта способствуют решению индивидуальных реабилитационных задач.
Противоэпилептические препараты. Что вы должны о них знать?
Как действуют противоэпилептические препараты? Как подбираются и как их правильно принимать? Что делать в случае побочных эффектов? Отличаются ли оригинальные противосудорожные препараты от генерических?
Противоэпилептические препараты – это фармацевтические препараты применяемые для лечения эпилепсии, позволяющие нормализовать электрическую активность головного мозга и контролировать эпилептические приступы.
История противосудорожных препаратов
Современное лечение противосудорожными препаратами началось с использования бромидов. Их начали применять с 1853 года и использовали на протяжении полвека. В течение этого времени были разработаны более новые препараты, которые постепенно заменили бромиды, так как последние вызывали большое количество побочных эффектов.
До 1978 года стали применять 6 дополнительных средств, включая Фенитоин и Тегретол. Они были разработаны в процессе проведения экспериментов над крысами и поэтому носят название “препараты старого поколения”.
В этот период существенно изменился подход к разработке препаратов: производители, а также медицинское сообщество пытались понять механизмы, вызывающие приступы, чтобы повысить эффективность антиэпилептических лекарств.
Современные антиконвульсанты способны снижать возбудимость нейронов эпилептического очага при нескольких механизмах одновременно. В основном механизм заключается либо в в торможении активирующих нейронов, либо в активации ингибирующих нервных клеток.
Насколько эффективны таблетки от эпилепсии
По статистике, примерно 70% детей и взрослых с эпилепсией, смогут избавиться от эпилептических приступов с помощью медикаментозного лечения, но будут и такие, которым медикаментозное лечение не поможет.
Несмотря на громадные средства, которые идут на исследования и производство новых препаратов от эпилепсии, у 30% пациентов приступы будут продолжаться и им потребуются другие решения, такие как: оперативное лечение, кетогенная диета, имплантация стимулятора блуждающего нерва, либо приём препаратов на основе медицинского каннабиса, обогащенными CBD. Подробнее о лечении пациентов с устойчивым к медикаментозной терапии видом заболевания читайте на странице Фармакорезистентная эпилепсия.
Стоимость противоэпилептических препаратов
В каждой стране цена противоэпилептических препаратов в аптеках будет отличаться по разным причинам. В некоторых странах часть стоимости оплачивается государством (входит в корзину субсидированных медикаментозных препаратов), что значительно снижает конечную стоимость для пациента.
Некоторые противоэпилептические препараты имеют высокую стоимость и на это есть своя причина. Время разработки каждого препарата включает в себя различные этапы и тесты. Из-за этого время разработки и внедрения каждого препарата достаточно велико – для того, чтобы создать препарат, который будет отвечать всем стандартам регулятора, может понадобится более 5 лет. Стоимость разработки при этом составляет примерно 500 млн. долларов. Именно поэтому новые противоэпилептические препараты нового поколения, которые начали использовать относительно недавно, имеют высокую стоимость.
Чем отличаются препараты от эпилепсии, доступные в наших аптеках, от лекарств, используемых в Израиле?
К сожалению, в России, Украине, Казахстане и некоторых других странах бывшего СССР не все доступные противоэпилептические препараты разрешены к использованию, а также есть недостаток лекарств в аптеках. Это ограничивает варианты возможного лечения.
В Израиле применяют более 20 современных противоэпилептических препаратов, благодаря чему количество возможных протоколов лечения увеличивается и повышается шанс подобрать подходящий пациенту препарат.
Список противоэпилептических препаратов

- Можно ли вылечить эпилепсию?
- Переходит ли эпилепсия по наследству?
- Помогают ли альтернативные методы лечения контролировать приступы?
- Что нельзя делать при эпилепсии?
- Сколько должен спать пациент с эпилепсией?
- Чем опасны приступы эпилепсии во сне?
- Как помочь пациенту во время приступа?
- Можно ли заниматься спортом?
- Может ли эпилепсия привести к проблемам в учебе, задержке развития, проблем с памятью и поведением?
Введите адрес вашей электронной почты и проверьте почту через 5 минут
Новейшие — третьего поколения — противоэпилептические препараты
Основным компонентом в комплексном лечении эпилепсии является фармакотерапия — применение антиконвульсантов, или противоэпилептических (син.: антиэпилептических) препаратов (ПЭП). Напомним ряд ключевых положений фармакологического лечения при эпилепсии (Юрьев К.Л., 2004).
Цель фармакотерапии при эпилепсии — полное устранение эпилептических припадков при отсутствии побочных эффектов ПЭП. Этой цели удается достичь у 60% пациентов с эпилепсией, нуждающихся в лечении ПЭП. К сожалению, у многих пациентов наблюдается непереносимость побочных эффектов лекарственной терапии или резистентность к проводимому медикаментозному лечению.
Важное значение имеет монотерапия, поскольку при этом снижается вероятность развития побочных эффектов и исключаются проблемы, связанные со взаимодействием лекарств. Кроме того, монотерапия может быть дешевле, поскольку многие ПЭП (в основном традиционные) обладают способностью активации процессов биотрансформации в печени путем индукции энзимов, что приводит к снижению концентрации в плазме крови препаратов сопутствующей терапии и таким образом требует повышения дозы.
Выбор ПЭП зависит от типа припадков (специфического эпилептического синдрома), возраста пациента, сопутствующей терапии, а также переносимости, безопасности, эффективности ПЭП и ряда других важных факторов, в частности — механизма действия и фармакокинетических свойств ПЭП, особенно при политерапии заболевания.
Краткая история становления фармакотерапии при эпилепсии представлена ниже по J.G. Ochoa, W. Riche (2012).
Начало современных подходов к медикаментозной терапии эпилепсии относят к 1850 г., когда для лечения больных стали применять бромиды, основываясь на теории о том, что причиной этого заболевания является чрезмерное половое влечение.
В 1910 г. выявлено, что противоэпилептической активностью обладает фенобарбитал [phenobarbital, PB]*, который с этого времени и на долгие годы стал препаратом выбора в лечении эпилепсии. В дальнейшем были разработаны другие, подобные фенобарбиталу, препараты, включая примидон [primidone, PRIM].
В 1940 г. была установлена противоэпилептическая эффективность фенитоина [phenytoin, PHT], который с этого времени стал основным ПЭП первой линии терапии при парциальных и вторично-генерализованных эпилептических припадках.
В 1968 г. в клиническую практику был внедрен карбамазепин [carbamazepine, CBZ], вначале для лечения невралгии тройничного нерва, а позднее, с 1974 г. — парциальной эпилепсии.
С 1958 г. в качестве препарата первого выбора для лечения абсансов, не сопровождающихся генерализованными тонико-клоническими припадками, применяют этосуксимид [ethosuximide, ESX, ESM].
Вальпроевая кислота [valproic acid, VPA] (принятое в США название — вальпроат натрия [valproate sodium]) одобрена для применения в Европе с 1960 г., в США — с 1978 г., и в настоящее время широко применяется во всем мире. Она стала препаратом выбора при первично-генерализованной эпилепсии, а с 1990-х годов одобрена для лечения парциальной эпилепсии.
Перечисленные выше ПЭП, которые в настоящее время называют традиционными, или ПЭП первого поколения, были «оплотом» в терапии эпилепсии вплоть до 1990-х годов, когда были разработаны новые — второго поколения — ПЭП.
Стимулом к разработке новых ПЭП послужил тот факт, что у >30% пациентов при применении вышеуказанных 6 традиционных ПЭП (и ряда других препаратов, например таких, как клоназепам [clonazepam, CLN], ацетазоламид [acetazolamide, ACZ]) наблюдается резистентность к проводимому лечению или же, в случае достижения адекватного контроля припадков, развиваются серьезные или непереносимые побочные эффекты (McCabe P.H., 2000).
Начиная с 1990-х годов на мировой фармацевтический рынок были выведены 10 новых ПЭП (второе поколение). К этим препаратам относятся: 1) фелбамат [felbamate, FBM]; 2) габапентин [gabapentin, GBP]; 3) ламотригин [lamotrigine, LTG]; 4) топирамат [topiramate, TMP]; 5) тиагабин [tiagabine, TGB]; 6) окскарбазепин [oxcarbazepine, OXC]; 7) леветирацетам [levetiracetam, LVT или LEV]; 8) зонизамид [zonisamide, ZNS]; 9) клобазам [clobazam, CLB]; 10) вигабатрин [vigabatrin, VGB]. Считают, что преимуществами новых ПЭП по сравнению с традиционными являются высокая эффективность в сочетании с меньшей токсичностью, лучшей переносимостью и удобством применения (отсутствие необходимости проведения регулярного мониторинга концентрации препарата в крови) (Ochoa J.G., Riche W., 2012).
Первоначально новые ПЭП были зарегистрированы для применения в качестве дополнительной (add-on, adjunctive) терапии при медикаментозно резистентной (далее по тексту — резистентной) парциальной эпилепсии. В дальнейшем ряд новых ПЭП получил одобрение для применения в монотерапии (Юрьев К.Л., 2004).
К сожалению, внедрение в клиническую практику ПЭП второго поколения не решило окончательно проблему оптимального ведения пациентов с эпилепсией — по-прежнему в ≈30% случаев не удается достичь адекватного контроля припадков (Bialer M., 2006).
Такое положение вещей служит мощным стимулом к дальнейшему поиску новейших ПЭП.
В настоящее время при разработке новейших ПЭП используют 3 различных подхода (Luszczki J.J., 2009).
Первый заключается в химической и/или структурной модификации уже известных ПЭП. При таком подходе можно получить препарат, обладающий более выраженной противоэпилептической активностью и/или менее выраженными побочными эффектами по сравнению с предшественником.
Второй метод сводится к скринингу большого количества различных субстанций в отношении противоэпилептической активности в экспериментальных моделях эпилепсии (in vivo и in vitro). Такая техника позволяет открывать совершенно новые соединения, обладающие противоэпилептической активностью.
И, наконец, третий метод создания новейших ПЭП основывается на достижениях в изучении патофизиологических механизмов эпилептогенеза и нейрональной гипервозбудимости. К примеру, потенциальными кандидатами на роль ПЭП могут быть соединения, которые селективно ингибируют возбудительную нейротрансмиссию, либо активируют тормозные синапсы в головном мозгу.
В ряде случаев одновременно используют два или три метода поиска новейших ПЭП.
На сегодняшний день фармацевтическими компаниями уже разработаны 20 ПЭП следующего — третьего — поколения: бриварацетам [brivaracetam, BRI]; валроцемид [valrocemide, VLR]; ганаксолон [ganaxolone, GNX]; караберсат [carabersat, CRB]; карисбамат [carisbamate, CBM]; лакосамид [lacosamide, LCM] (прежние INN — эрльозамид, erlosamide); лозигамон [losigamone, LSG]; прегабалин [pregabalin, PGB]; ремацемид [remacemide, RMC]; ретигабин [retigabine, RTG]; руфинамид [rufinamide, RUF]; сафинамид [safinamide, SAF]; селетрацетам [seletracetam, SEL]; соретолид [soretolide, SRT]; стирипентол [stiripentol, STP]; талампанел [talampanel, TLP]; флуорофелбамат (fluorofelbamate, FFBM); фосфенитоин [fosphenytoin, FPHT]; эсликарбазепин [eslicarbazepine, ESL]; DP- вальпроевая кислота (DP-valproic acid, DP-VPA). Эти препараты продемонстрировали противоэпилептическую активность в доклинических исследованиях и в настоящее время находятся на фазе клинических испытаний или близки к этому (Luszczki J.J., 2009).
Для того чтобы получить представление о направленности и интенсивности клинических испытаний новейших ПЭП и, следовательно, о перспективах их внедрения в рутинную клиническую практику, мы провели поиск в американском метарегистре клинических испытаний ClinicalTrials.gov (подробнее о метарегистрах клинических испытаний — см. Юрьев К.Л., 2005) и проанализировали информацию об идентифицированных завершенных, прерванных и текущих рандомизированных клинических испытаниях (РКИ) новейших ПЭП по состоянию на апрель 2012 г. Также нами проведен поиск публикаций завершенных РКИ в электронном архиве Национальной медицинской библиотеки США (PubMed.gov). Результаты проведенной работы представлены в таблице (препараты ранжированы по количеству текущих РКИ).
| № п/п | ПЭП | Количество текущих РКИ (ClinicalTrials.gov) | Количество публикаций результатов РКИ (PubMed.gov) | Основные изучаемые/изученные показания/эффекты/свойства |
|---|---|---|---|---|
| 1 | Валроцемид | |||
| 2 | Караберсат | |||
| 3 | Соретолид | |||
| 4 | Флуорофелбамат | |||
| 5 | DP-вальпроевая кислота | |||
| 6 | Лозигамон | 5 | I. Эпилепсия: |
- парциальная;
- резистентная;
- дополнительная терапия;
- взрослые
- парциальные, сложные парциальные или генерализованные тонико-клонические припадки;
- резистентная
- дополнительная терапия;
- взрослые
II. Хорея Гентингтона
III. Болезнь Паркинсона
IV. Нейропротекция (в том числе при остром ишемическом инсульте)
V. Влияние на когнитивные и психомоторные функции
- парциальная;
- резистентная;
- дополнительная терапия;
- дети
- безопасность, эффективность и фармакокинетика при применении внутривенно у пациентов нейрохирургического профиля, с черепно-мозговой травмой, эпилепсией или эпистатусом;
- дети в возрасте старше 2 лет;
- взрослые
- частые бессудорожные припадки;
- внутривенное введение;
- взрослые
II. Фармакокинетика и лекарственные взаимодействия
- парциальная;
- резистентная;
- дополнительная терапия;
- взрослые
IB. Эпилепсия — инфантильный спазм (дети)
II. Посттравматическое стрессовое расстройство
IС. Эпилепсия — сравнение с кетогенной диетой у детей
II. Генерализованное тревожное расстройство
III. Гипералгезия, аллодиния
IV. Влияние на когнитивные функции
- парциальная;
- резистентная;
- дополнительная терапия;
- взрослые (18–65 лет)
II. Боковой амиотрофический склероз
III. Мультиформная глиобластома, глиома
IV. Болезнь Паркинсона
V. Влияние на ритм сердца
- парциальная;
- резистентная;
- дополнительная терапия;
- взрослые (18–75 лет)
IB. Эпилепсия — парциальная или синдром Леннокса — Гасто:
- резистентная;
- дополнительная терапия;
- подростки (12–18 лет)
II. Постгерпетическая невралгия
- парциальная;
- резистентная;
- дополнительная терапия;
- взрослые (старше 16 лет)
II. Диабетическая нейропатия
III. Постгерпетическая невралгия
IV. Мигрень (профилактическое лечение)
- парциальная;
- резистентная;
- дополнительная терапия;
- монотерапия;
взрослые (старше 16–18 лет)
IB. Эпилепсия: парциальная;
- резистентная;
- дополнительная терапия;
- дети (2–16 лет)
II. Постгерпетическая невралгия
III. Диабетическая нейропатия
- парциальная;
- резистентная;
- дополнительная терапия;
- монотерапия;
- подростки и взрослые (16–75 лет)
IB. Эпилепсия фотосенситивная (взрослые, 18–60 лет)
IC. Эпилепсия — болезнь Унферрихта — Лундборга (Unverricht — Lundborg) у подростков и взрослых (16 лет и старше)
ID. Эпилепсия — открытое испытание препарата в качестве дополнительной терапии у детей (до 16 лет)
II. Постгерпетическая невралгия
III. Влияние на когнитивные функции
- парциальная;
- резистентная;
- дополнительная терапия;
- монотерапия;
- подростки и взрослые (16–70 лет)
IB. Эпилепсия — открытое испытание препарата в качестве дополнительной терапии при парциальной эпилепсии у детей (от 1 мес до 17 лет)
IC. Эпилепсия — открытые испытания препарата при первично генерализованных тонико-клонических припадках у взрослых (16–65 лет)
ID. Эпилепсия — профилактика припадков при глиоме
IE. Эпилепсия — влияние на цикл сон — бодрствование, когнитивные функции и поведение, настроение и качество жизни
IF. Эпилепсия — безопасность, переносимость и эффективность внутривенной формы препарата
IG. Эпилепсия — фармакогенетическое исследование ответа на терапию препаратом
II. Мигрень (профилактическое лечение)
III. Болевой синдром: ноцицептивная боль (остеоартроз); хроническая нейропатическая боль (диабетическая нейропатия, постгерпетическая невралгия, фибромиалгия)
IV. Влияние на качество сна, возбудимость моторной коры, а также нейропсихологические эффекты у здоровых добровольцев
- парциальная;
- дополнительная терапия;
- монотерапия; взрослые (старше 18 лет);
- дети и подростки (от 1 мес до 16 лет)
- первично генерализованные тонико-клонические припадки;
- дополнительная терапия;
- дети и взрослые (5–65 лет)
II. Болевой синдром:
- ноцицептивная боль (после хирургических вмешательств различной локализации);
- хроническая нейропатическая боль (центральная нейропатическая боль после инсульта, травм спинного мозга;диабетическая нейропатия; постгерпетическая невралгия;полинейропатия; лицевая боль;боль в нижней части спины (low back pain); фибромиалгия; вульводиния; синдром раздраженного кишечника и др.)
III. Двигательные нарушения:
- эссенциальный тремор;
- синдром беспокойных ног (Restless legs syndrome)
IV. Тревожные расстройства:
- генерализованное тревожное расстройство;
- обсессивно-компульсивное расстройство (дополнительная терапия при неэффективности селективных ингибиторов обратного нейронального захвата серотонина)
Из представленных в таблице данных видно, что 13 из 20 новейших ПЭП уже тестируются в текущих клинических испытаниях. Причем, эффективность, безопасность и переносимость ПЭП третьего поколения изучаются не только при эпилепсии, но и в достаточно широком круге другой нервно-психической патологии (см. таблицу).
Клинические испытания ремацемида в настоящее время не проводятся. Однако препарат занимает второе место по количеству опубликованных результатов РКИ. Это можно объяснить следующим. В выводах систематического обзора Кокрановского сотрудничества, пересмотренного в 2010 г. (2 РКИ, 514 участников), отмечается, что возможность применения ремацемида в качестве ПЭП вызывает сомнения из-за умеренного влияния препарата на снижение частоты возникновения эпилептических припадков и высокой частоты его отмены (Leach J.P. et al., 2002; Юрьев К.Л., 2003).
Из новейших ПЭП, прегабалин — не только наиболее интенсивно изучаемый (250 РКИ), но и наиболее изученный на сегодняшний день препарат (138 публикаций).
К достаточно интенсивно изучаемым ПЭП третьего поколения можно отнести также лакосамид и ряд других препаратов (см. таблицу).
Отметим, что в настоящее время в Украине уже зарегистрированы препараты прегабалина (N03AX16**) и лакосамида (N03AX18).
Без сомнения, в скором времени в арсенале практикующих неврологов и психиатров можно ожидать появления и других представителей третьего поколения ПЭП.
*В статье приводятся международные непатентованные названия препаратов (International Nonproprietary Names/INN), рекомендованные Всемирной организацией здравоохранения — www.whocc.no (за исключением препаратов флуорофелбамат и DP-вальпроевая кислота). При первом упоминании ПЭП в квадратных скобках приведено английское название и общепринятое в англоязычной литературе сокращение.
**Код препарата согласно унифицированной анатомо-терапевтической и химической классификации лекарственных средств — классификационной системе АТС (Anatomical Therapeutic Chemical classification system): N — Средства, действующие на нервную систему; N03 — Противоэпилептические средства; N03A X — Прочие противоэпилептические средства (Компендиум 2011 — лекарственные препараты, 2011).
Противосудорожные препараты
Противосудорожные препараты появились всего 100 лет назад. Последние десятилетия ученые и производители открывают новые соединения и выпускают на рынок все новые лекарства. Как сделать правильный выбор?
Судороги — это непроизвольные мышечные сокращения. Они могут быть и у здоровых людей после перегрузки определенных мышц, например, у спортсменов, скрипачей, при переохлаждении в воде. При засыпании и во время сна нередки судорожные непроизвольные подергивания. Но также судороги различного типа могут быть симптомами эпилепсии.
Эпилепсия
Эпилептические приступы, возникшие без какой-либо видимой причины два и более раз, могут считаться эпилепсией. Эпилептическим приступом называется ненормальный или избыточный разряд нейронов головного мозга с видимыми проявлениями. Видимые проявления не всегда судороги и потеря сознания, это могут быть:
- только изменения сознания;
- психические проявления;
- двигательные изменения;
- вегетативные проявления.
Для конкретного человека эти симптомы могут быть в виде звона в ушах, вспышек света или пламени, покраснение лица, кратковременных нарушениях речи, памяти и многих других. Это зависит от места, где нервный импульс вырвался из-под контроля и активировал ту или иную область мозга. Причем эти изменения могут быть первыми замечены другим человеком, а не самим пациентом. Так может быть, например, с эпизодами замирания на несколько секунд. Если у этих симптомов есть явная причина, травма головы, опухоль мозга, это не является эпилепсией.
Выделяют множество форм эпилепсии в зависимости от вида эпилептических припадков, типов эпилепсии и эпилептического статуса (эпиприступ длящийся более 30 минут одномоментно или череда приступов без полного восстановления сознания).
Если у симптомов есть явная причина, то это не является эпилепсией.
Судороги
Можно подумать, что судороги возникают только при эпилепсии. Поэтому при их появлении обязательно нужны противосудорожные препараты. Кроме эпилепсии может быть еще множество состояний, не имеющих к ней никакого отношения, но которые могут сопровождаться судорогами:
- Заболевания сосудов головного мозга, возраст более 75 лет и геморрагические инсульты нередко служат причиной начала острых симптоматических судорожных приступов.
- Черепно-мозговые травмы.
- Инфекционные болезни центральной нервной системы (менингит, энцефалит, ВИЧ-инфекция).
- Кислородное голодание головного мозга.
- Интоксикация организма.
- Прием лекарственных препаратов.
- Острые обменные нарушения, например, гипогликемия при лечении сахарного диабета, нарушения электролитного баланса.
- Синдром отмены при прекращении употребления алкоголя.
- Прием больших доз алкоголя.
- Прием психотропных препаратов (психотропных стимуляторов — кокаин, крэк, «экстази»).
- Температура выше 38,5 °C у детей до 7 лет может давать фебрильные судороги.
- Печеночная недостаточность.
- Болезнь Паркинсона.
Поэтому самостоятельный прием противосудорожных препаратов без назначений врача запрещен. Сначала нужно установить причину проблемы и только потом лечить.
Подходы к приему противосудорожных препаратов
Если раньше главной целью терапии эпилепсии и приема противосудорожных препаратов было недопущение новых приступов, то сегодня на первое место выходит комплексный подход с учетом качества жизни пациента, сохранения его работоспособности на фоне лечения
Подбор эффективной терапии может быть затруднительным. На это влияют такие факторы, как соблюдение режима приема препаратов, побочные эффекты. Смена препаратов по торговому наименованию, но с одним и тем же действующим веществом также может привести к обострению проблем.
Обычно в начале лечения эпилепсии используют один препарат, но может меняться дозировка, лекарство. Если не достигнут нужный результат, только тогда подключают второе средство и используют различные комбинации.

Иногда п одбор эффективной терапии может быть затруднительным.
Противосудорожные препараты
Для лечения эпилепсии используют 3 основных механизма:
- Стабилизация мембранного потенциала нервных клеток за счет влияния на ионные каналы. Благодаря этому ионы К + остаются в клетке, а ионы Na + снаружи. Воздействие может осуществляться также через Ca 2+ -каналы. Это сохраняет «покой» на мембране нервных клеток.
- Подавление процессов, участвующих в возбуждении.
- Усиление тормозящих механизмов.
Многие препараты действуют на несколько механизмов сразу и разделить их на группы по этому признаку не получится.
Лекарства:
Депакин Хроносфера , Конвулекс , Энкорат хроно . Препараты вальпроевой кислоты. Обладают миорелаксирующим действием и усиливают тормозные процессы в головном мозге. Может замедляться всасывание препарата при приеме с пищей. К побочным эффектам отнесены : увеличение массы тела, выпадение волос, проблемы с желудочно-кишечным трактом, тремор.
Финлепсин ретард , Тегретол ЦР , Карбатол. Относятся к препаратам карбамазепина, используются при больших судорожных припадках и смешанных формах эпилепсии. Противопоказания абсансные и миоклонические припадки. Побочные эффекты: головокружение, сонливость, головная боль, но прекращение приема вызывает чаще кожная сыпь.
Фенобарбитал , Бензонал , Майсолин . Относятся к группе барбитуратов. Могут применяться при любых типах приступов эпилепсии. Часто применяется у младенцев. Выражено замедление психических процессов. У детей бывает обратная реакция и развивается гиперреактивность. Они снижают двигательную активность, могут вызывать сонливость. Противосудорожное действие реализуется за счет препятствия возникновения и распространения импульса из очага активности. Абсансная форма идиопатической эпилепсии будет противопоказанием к приему.
Фризиум , Реланиум , Мерлит. Относятся к группе бензодиазепинов. Особенно часто используются при прогрессирующей миоклонической эпилепсии. Но со временем эффект может снижаться и развиваться зависимость .
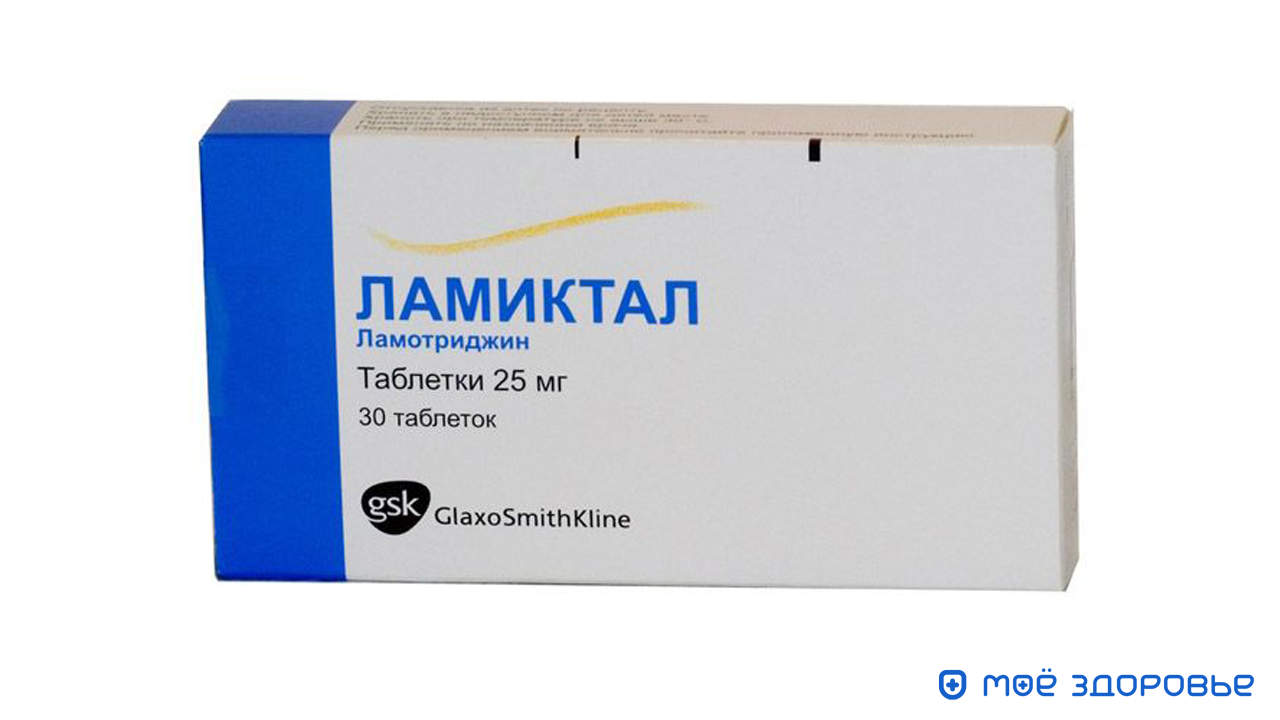
Ламиктал , Памолен. Действующее вещество ламотриджин. Эффективен при любых видах припадков, но при миоклонии рекомендуется избегать. Основной побочный эффект — сыпь, выраженность которой резко возрастает при комбинациях с вальпроатами и карбамазепином.
Топамакс (топирамат). Действует на разные механизмы в предотвращении приступов, эффективен у взрослых и у детей. Начинают прием с минимальных доз и медленно увеличивают. С осторожностью применяется у детей с нарушениями речи, а также при проблемах со сном. Один из побочных эффектов — потеря веса, поэтому не следует применять у «худых» пациентов.
Кеппра , Леветинол. Действующее вещество леветирацетам. Оптимальное действие при эпилептических миоклониях, не взаимодействует с другими препаратами. Не следует применять у пациентов склонных к возбуждению и нарушениям сна.
Суксилеп. Ранее был препаратом выбора при лечении абсансных припадков, теперь уступил это место вальпроевой кислоте. Противопоказан при психических проблемах. Побочные эффекты: головная боль, сонливость, желудочно-кишечные симптомы.
Тебантин , Нейронтин , Габапентин. Структурно схожи с ГАМК, не трансформируются в печени, поэтому могут использоваться со многими другими препаратами и при болезнях печени. Побочные действия: слабость, головокружение, увеличение веса тела.
Так как лечение эпилепсии во многих случаях предполагает пожизненный прием препаратов, важно соотношение их эффективности и токсичности. Также играют роль пути метаболизма препаратов (в печени), взаимодействие с другими препаратами при сопутствующих заболеваниях. Подбор терапии противосудорожными препаратами совместная работа врача и пациента.
Противоэпилептические препараты нового поколения
а) Общие принципы лекарственной терапии эпилепсии у детей. Лекарственная терапия является основной формой лечения большинства детей с пароксизмальными расстройствами. Основные доступные в настоящее время препараты, основные данные о фармакокинетике — в таблицах ниже. Помимо препаратов первого выбора, хорошие результаты иногда дает применение таких агентов, как клоразепат (Naidu et al., 1986; Fujii et al., 1987), бромиды (Steinhof и Kruse, 1992) и сультиам (Lerman, Lerman-Sagie 1995; Ben-Zeev et al., 2004), так же как и других «малых» препаратов (Levy et al., 2002).
За последние 20 лет было разработано несколько АЭП широкого спектра, включая ламотриджин, ле-ветирацетам, топирамат, фелбамат и зонисамид. Другие, такие как окскарбазепин, габапентин, вигабатрин и тиагабин, показаны для контроля фокальных припадков. Данные контролируемых исследований действия препаратов у детей зачастую отсутствуют, и лекарства часто используются без лицензии на основе данных, полученных при исследованиях взрослых пациентов.
Неспецифические препараты, такие как АКТГ и кортикостероиды высокоэффективны при лечении не только инфантильных спазмов, но также и других типов резистентной эпилепсии, особенно при появлении когнитивных и/или поведенческих нарушений. В таких случаях требуется проведение полного курса (2-4 недели) пробной терапии.
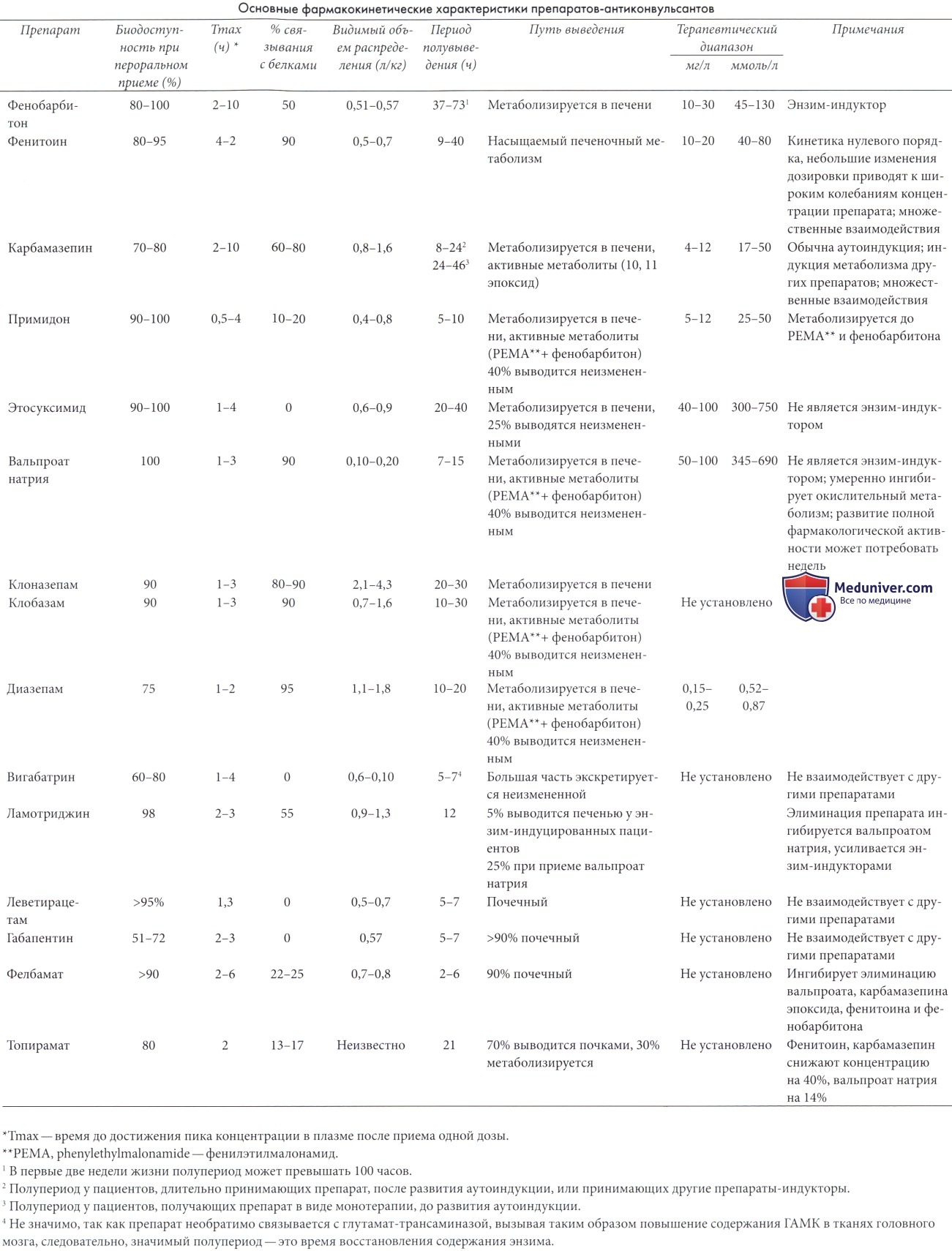
Механизм действия АЭП не является предметом рассмотрения данного руководства (подробнее см. Levy et al., 2002; Wyllie et al., 2006). Основные этапы метаболизма АЭП приведены на рисунке 15.9. Этапы от абсорбции до поступления и распределения в тканях головного мозга составляют фармакокинетику препарата. Большой объем сведений накоплен за последнее двадцатилетие о фармакокинетике АЭП, особенно у детей (Dodson Pellock, 1993; Kearns et al., 2003; Booth и Evans, 2004).
Следующие этапы, приводящие к изменениям нейрональной возбудимости, составляют фармакодинамическую фазу действия препарата. Первые фармакокинетические этапы (от абсорбции до поступления в ткани головного мозга) отражаются концентрацией препарата в крови. Было продемонстрировано, что содержание препарата в тканях головного мозга в большей степени зависит от концентрации антиэпилептического препарата (АЭП) в крови, чем от введенной дозы, что является основанием для определения и коррекции дозировки. Однако концентрация препарата в крови представляет лишь звено в цепочке процессов, происходящих между введением препарата и развитием его терапевтических и побочных эффектов, и действие препарата на рецепторы не всегда напрямую определяется содержанием препарата в тканях головного мозга.
Такое расхождение часто наблюдается при применении вальпроата натрия и возможно при приеме карбамазепина (Suzuki et al., 1991; Scheyer et al., 1994). У некоторых детей наблюдается атипичная реакция на прием антиконвульсантов, в этих случаях могут быть показаны специальные исследования метаболизма препарата (Gilman et al., 1994).
Схематическое изображение последовательных этапов от назначения антиэпилептического препарата (АЭП) до развития терапевтического эффекта.
Обратите внимание, что некоторые побочные или токсические эффекты могут зависеть только от наличия препарата в крови
(например, кожная сыпь, гепато- или нефротоксичность, взаимодействие с другими препаратами), тогда как для развития других (например, атаксии, сонливости),
также как и для развития терапевтического эффекта, необходимо наличие препарата в тканях головного мозга.
б) Показания и методы применения эпилепсии у ребенка:
1. Начало лечения. Начало антиэпилептического лечения — серьезное решение, требующее тщательной диагностики эпилепсии. Следовательно, лекарственная терапия не должна назначаться при пароксизмальных состояниях неясного генеза (Arzimanoglou et al., 2004), или с одиночным припадком (за исключением типа припадков, наблюдающихся только при хронических эпилепсиях), или при наличии нарушений ЭЭГ без явных клинических проявлений (Hirtz et al., 2000; Arts et al., 2004; Beghi, 2007). Также лучше избегать назначения превентивной лекарственной терапии пациентам с потенциально эпилептогенными поражениями головного мозга, так как ее эффективность не доказана, и она может привести к необоснованному приему лекарств в течение многих лет (Shinnar и Berg, 1996).
Сложную проблему составляют дети с пароксизмальными разрядами на ЭЭГ и сопутствующими непароксизмальными проявлениями, такими как поведенческие или когнитивные нарушения. Существуют доказательства роли ЭЭГ-изменений в патогенезе этих нарушений (Nicolai et al., 2006), особенно если они выражены и существуют длительное время. Лечение определенно показано при некоторых синдромах тяжелой деградации, таких как CSWSS или синдром Ландау-Клеффнера, даже если имеются лишь отрывочные данные о его эффективности. В действительности эти синдромы зачастую резистентны к традиционному лечению, и реакция на какую-либо форму лечения с трудом поддается оценке.
Большинство клиницистов не склонны лечить детей с нарушением обучения или недостаточностью внимания только из-за наличия у них ЭЭГ-аномалий. Фактически, решение о выборе лечения должно приниматься строго индивидуально, и предпочтительно детским неврологом с опытом в области эпилепсий у детей.
Дети, у которых зафиксировано два и более припадка или у которых на основании картины имевшегося припадка можно заподозрить хроническую эпилепсию, являются кандидатами на назначение лекарственной терапии. Тем не менее, некоторые исследователи склонны воздерживаться от лечения пациентов с нечастыми припадками с невыраженной симптоматикой и/или припадками, развивающимися в социально «приемлемое» время. Если припадки развиваются относительно редко, решение о начале лечения в большой степени зависит от образа жизни и предпочтений самого пациента и от его родителей (Beghi, 2007).
2. Выбор препарата(oв) для лечения эпилепсии у ребенка. Выбор препарата(ов) зависит в первую очередь от эпилептического синдрома или, по крайней мере, от типа развившегося у пациента припадка (Arzimanoglou, 2002). В таблице ниже указан порядок выбора обычных антиэпилептических препаратов (АЭП) при наиболее часто встречающихся типах детской эпилепсии. В некоторых случаях выбор препарата делается совершенно произвольно, отчасти в связи с тем, что ни эффективность препарата, ни его нежелательные эффекты полностью предсказать невозможно (Arzimanoglou et al., 2004).
Выбор первого препарата определяется его токсичностью, наличием побочных эффектов и специфической переносимостью конкретного препарата, так как зачастую несколько различных препаратов имеют сравнимую эффективность. Это не относится к абсансам и многим миоклоническим припадкам, при которых чаще всего активны вальпроат натрия, этосуксимид, леветирацетам и бензодиазепины. Сравнительные исследования у взрослых (Mattson et al., 1992, Richens et al., 1994) и у детей (Verity et al., 1995; de Silva et al., 1996) не выявили значимых различий в эффективности общепринятых препаратов (фенобарбитон, фенитоин, карбамазепин, вальпроат натрия) при их применении в виде монотерапии при парциальных или генерализованных судорожных припадках. Эти результаты не исключают возможности того, что некоторые лекарства эффективнее других в подгруппах пациентов или в отдельных случаях.
Получены данные, указывающие на то, что некоторые препараты лучше работают при генерализованных формах эпилепсии или обладают широким спектром активности, позволяющим контролировать и фокальные, и генерализованные припадки (вальпроат натрия, ламотриджин, леветирацетам, топирамат, зонисамид), тогда как другие показаны при фокальных припадках (карбамазепин, габапентин, окскарбазепин, вигабатрин). Также получены данные, что некоторые препараты при некоторых формах эпилепсии могут скорее усугублять, чем облегчать течение болезни (например, карбамазепин при идиопатической генерализованной эпилепсии или синдромах с преимущественно миоклоническими припадками или типичными абсансами, ламотриджин в некоторых случаях синдрома Драве).
Однако все это относится лишь к первичному выбору препарата, тогда как в резистентных случаях с тонико-клоническими припадками строгое следование правилам может приводить к обратным результатам.
Во многих случаях вероятность развития побочных эффектов становится определяющим фактором при выборе препарата. Выраженные побочные эффекты наблюдаются редко (см. ниже), но даже относительно легкие побочные эффекты должны приниматься во внимание, так как их влияние на повседневную жизнь может быть значительным. Так, выбирая между карбамазепином, фенобарбиталом и фенитоином, предпочтение должно отдаваться первому из этих препаратов, так как он гораздо легче переносится, чем фенитоин и не вызывает поведенческих или когнитивных расстройств, связанных с приемом фенобарбитала, или «малых» побочных эффектов, таких как гиперплазия десен и гирсутизм, часто наблюдаемых при приеме фенитоина. Из-за подобных побочных эффектов возник миф о якобы существующем внешнем отличии пациентов с эпилепсией от других детей.
Антиэпилептические препараты (АЭП) нового поколения, как оказалось, гораздо лучше переносятся как при коротких курсах, так и при длительном приеме, чем старые антиэпилептические препараты, и должны считаться препаратами первого выбора.

3. Монотерапия или политерапия эпилепсии у ребенка. Преимуществами назначения одного препарата являются меньшее, чем при назначении комбинации препаратов число побочных эффектов, создающих «помехи», и отсутствие проблемы взаимодействия лекарственных средств. Следовательно, лечение почти всегда должно начинаться с назначения одного препарата. От 70 до 90% впервые выявленных эпилепсий часто встречающихся форм можно контролировать при монотерапии (Forsythe и Stills, 1984; Brodie, 1990).
Комбинации препаратов должны назначаться только тогда, когда терапия одним препаратом в адекватной дозировке в течение достаточного для оценки результатов периода времени оказалась безрезультатной. В случае неэффективности одного препарата назначению комбинации лекарств должна предшествовать постепенная замена одного препарата другим. Польза от добавления второго препарата до настоящего времени не определена. При таком лечении приблизительно у 15-20% пациентов удается улучшить контроль над припадками, но в некоторых случаях возможно ухудшение, также наблюдается тенденция к нарастанию побочных эффектов.
Комбинации более чем двух препаратов назначаются редко (Aicardi и Shovron, 1998). Не существует единого мнения насчет того, сколько пробных курсов монотерапии требуется провести перед тем, как назначить комбинированное лечение. Авторы считают, что должно быть проведено по меньшей мере два курса соответствующими АЭП в максимально переносимой дозе. Данные открытых клинических исследований взрослых и подростков (Kwan и Brodie, 2000b, 2001) указывают, что полный контроль припадков очень редко достигается при назначении третьего препарата, если первые два оказались неэффективными. Вероятно, то же самое можно отнести и к детям. Тем не менее, при наличии у одного пациента разных типов припадков (например, при синдроме Леннокса-Гасто или синдроме Драве), требующих различного лечения (Aird et al, 1984; Реrucca и Levy, 2002), иногда приходится рано назначать комбинированную терапию.
Однако даже в таких случаях применение некоторых современных препаратов с широким спектром действия (например, вальпроата, ламотриджина, леветирацетама, топирамата) может снять необходимость назначения политерапии (Arzimanoglou, 2002).
4. Схемы применения. В принципе следует избегать назначения более двух доз препарата в день, за исключением случаев лечения высокорезистентной эпилепсии препаратами с коротким перидом полураспада. Некоторые препараты, например, фенобарбитон, вигабатрин или ламотриджин могут приниматься один раз в день вечером. Вальпроат натрия у подростков также может приниматься один раз в день, что улучшает выполняемость врачебных назначений; такая схема может оказаться эффективной при лечении первичных генерализованных эпилепсий (Covanis и Jeavons, 1980).
Правилом является постепенное увеличение или уменьшение дозировки в начале лечения и при отмене препарата. Первый или очередной препарат должен назначаться сначала в малой дозе, которая постепенно увеличивается, пока не будет достигнут контроль заболевания или порог переносимости. Это особенно важно для ламотриджина, так как при высоких начальных дозах увеличивается частота возникновения сыпи. Постепенная отмена также важна для барбитуратов, вигабатрина и фелбамата; при неэффективности первого назначенного препарата резкая отмена этих препаратов может спровоцировать эпилептический статус. Однако при часто встречающихся эпилепсиях у детей прекращение лечения может быть, в течение 4-8 недель не связано с высокой частотой рецидивов (Dooley et al., 1996).
Когда первый назначенный препарат оказался неэффективным и назначается другой, первый препарат должен отменяться постепенно. Нужно помнить, что для достижения стабильного уровня препарата требуется время, равное примерно четырем периодам полувыведения препарата из плазмы. Для достижения устойчивой концентрации может потребоваться более продолжительный период, так как дозировка препарата увеличивается постепенно, и в силу феномена индукции постепенно изменяется (обычно укорачивается) кажущееся время полувыведения препарата.
5. Наблюдение при терапии антиконвульсантами. Регулярные врачебные осмотры — единственное важное мероприятие. Особое внимание должно уделяться выявлению побочных эффектов, таких как диплопия или головокружение, что некоторые пациенты воспринимают как нормальные явления. Расстройства пищеварения, сонливость или нарушения речи также должны тщательно учитываться. Однако большинство этих побочных эффектов имеют транзиторный характер, и в большинстве случаев нет необходимости ранней отмены, при условии, что пациент заблаговременно проинформирован и титрование препарата производится медленно.
Вероятно, контроль количества клеточных элементов крови при приеме обычных препаратов бесполезен, кроме соображений безопасности (Camfield et al., 1986); то же самое относится и к проверке функции печени, так как умеренная лейкопения и увеличение активности трансаминаз встречаются часто и не являются проявлением печеночной недостаточности или панцитопении.
Клиническая оценка эффективности схемы приема препарата основывается на наличии рецидивов припадков. Оценка эффективности относительно несложна у пациентов с частыми, регулярно повторяющимися припадками (например, при абсанс эпилепсии), но она становится затруднительной и может потребовать месяцев и более у пациентов с редкими припадками, или у тех, у кого припадки развиваются нерегулярно или сериями. Но даже при возникновении этих проблем нельзя забывать, что конечной целью лечения является достижение контроля над припадками, а не нормализация ЭЭГ или создание «терапевтической» концентрации препарата в крови.
Контроль концентрации антиэпилептического препарата (АЭП) в крови обычно не показан. Он бесполезен у детей с хорошо контролируемой эпилепсией или получающих один препарат в малых дозах. У многих пациентов наблюдается отсутствие припадков при концентрациях препарата в крови значительно ниже опубликованных пределов, и коррекция дозировки для достижения «терапевтической» концентрации в таких случаях неэффективна (Woo et al., 1988) и повышает риск побочных эффектов. Сходным образом отмена препарата из-за его «субтерапевтической» концентрации может спровоцировать рецидив припадка (Richens, 1982). И, наоборот, в резистентных случаях доза препарата должна увеличиваться до достижения предела переносимости, независимо от концентрации препарата в крови.
Определение концентрации препарата в крови полезно при оценке выполнения назначений, т.е. согласия пациента с действиями врача; для подтверждения проявлений токсичности препарата у младенцев или у детей с умственной отсталостью, у которых диагностика может быть затруднена; для выявления взаимодействия препаратов при политерапии. Эти анализы также показаны при терапии фенитоином в качестве терапевтического показателя уровня безопасности, и особенно в неконтролируемых случаях и в случаях «прорыва» припадков у детей с прежде контролируемым заболеванием (Aicardi, 1994). Определение концентрации в крови некоторых препаратов (вигабатрин, леветирацетам) бесполезно, и представляет сомнительную ценность для других, например вальпроата натрия, чьи уровни концентрации плохо соотносятся с клиническими эффектами.
Трактовка результатов анализа содержания препарата в крови не всегда однозначна, особенно при взаимодействии препаратов (Levy et al., 2002), в случаях, когда количество связанного с белками препарата зависит от концентрации несвязанного препарата, а также при наличии активных метаболитов, когда скорость образования метаболита не является постоянной и концентрация в крови определяется нерегулярно.
Препараты для лечения эпилепсии в психиатрии

Противоэпилептические препараты (AED) широко использовались психиатрами для лечения расстройств, отличных от эпилепсии, в течение двух десятилетий. В настоящее время AED настолько широко используются для “неэпилептических показаний”, что наименование «антиэпилептическое лекарство» может граничить с неправильной маркировкой (перефразируя комментарий Дэвида Хили об ингибиторах обратного захвата серотонина и «антидепрессантах»). Как ни странно, новые AED могут оказаться более полезными при психических расстройствах , чем при эпилепсии, где более высокая эффективность новых препаратов, чем у более старых лекартсв, еще не была окончательно продемонстрирована.
Противоэпилептические препараты и литий
Ограниченные данные свидетельствуют о том, что в течение 1990-х годов использование АED примерно удвоилось, а использование лития упало ниже, чем использование АED. По крайней мере три вывода можно седлать из этого факта .
Во-первых, некоторые синдромы биполярного аффективного расстройства плохо реагируют на литий. Пациенты, плохо реагирующие на литий, включают пациентов со смешанными биполярными состояниями (состояния, которые включают смесь маниакальных и депрессивных признаков, часто проявляющих себя нетипично, например, в виде характерной раздражительности) и пациентов с быстрой цикличностью (определяемых как имеющие более четырех эпизодов настроения расстройство в течение года).
Во-вторых, биполярное расстройство настроения может быть гораздо более распространенным, чем предполагалось: хотя общепринятая эпидемиология предполагает, что униполярная депрессия встречается в несколько раз чаще, чем биполярное расстройство настроения, последние исследования показывают, что у половины пациентов с тяжелой депрессией может быть биполярность.
В-третьих, пациенты с биполярным расстройством часто страдают от субсиндромальных депрессивных симптомов в течение большей части своей жизни, но использование антидепрессантов у этих пациентов рискует вызвать манию или усугубить циркулярность.
Таким образом, препараты с эффективностью для биполярных депрессивных или смешанных состояний или для пациентов с резистентностью к литию особенно приветствуются, и значительное количество доказательств высокого качества – и намного больше неподтвержденных или неконтролируемых доказательств – поддерживают использование AED для этих показаний. Сообщения о психотропных эффектах вальпромида (амидного производного вальпроевой кислоты, доступного в Европе, но не в США) и карбамазепина появились вскоре после их введения. Divalproex (энтеросолюбильный препарат вальпроевой кислоты и вальпроата натрия, наиболее широко используемый препарат вальпроевой кислоты в Соединенных Штатах, поскольку он имеет меньше желудочно-кишечных побочных эффектов, чем вальпроевая кислота) и карбамазепин, как теперь было показано, эффективны при лечении острой мании со спектром действия, который включает в себя «неклассические» маниакальные состояния дисфорической мании и быструю смену фаз. Эффективность профилактики менее надежно подтверждается данными клинических испытаний, хотя многие клиницисты используют эти препараты, а также новые AED таким образом. Доказательства эффективности антидепрессантов скромны. По ограниченным данным, окскарбазепин обладает сходной эффективностью с карбамазепином, но обладает лучшей переносимостью. Карбамазепин снижал импульсивность у пациентов. В недавних исследованиях вальпроаты и ламотриджин продемонстрировали пользу для лечения агрессии, нестабильности настроения и импульсивности даже в отсутствие диагностируемого расстройства настроения.
AED стали широко использоваться для лечения ажитации и агрессии у пожилых людей, а также у детей и взрослых с неспособностью к обучению. Рассматривалась даже нейропротективная активность вальпроатов.
Увеличение веса является важным побочным эффектом для антидепрессантов, лития, карбамазепина и вальпроатов Возможность последних вызывать ожирение печени (в силу связи с метаболическим синдромом, а не из-за специфической гепатотоксичности) является дополнительной проблемой. Появление AED, которые являются нейтральными по весу, такими как ламотриджин и леветирацетам, или приводят к потере веса, таким как топирамат и зонисамид, является, таким образом, важным событием. Топирамат может найти конкретное применение при лечении булимии, а зонизамид был предметом впечатляюще благоприятного испытания, в котором он был назначен исключительно для похудения.
Данных из нескольких центров показывают , что вальпроат продуцирует повышенные уровни андрогенов , хотя это повышение может не коррелировать с симптоматическими признаками избытка андрогенов (синдром поликистоза яичников). Этот эффект, по-видимому, не зависит исключительно от увеличения веса, вызванного вальпроатом. Также обнаружено, что у мужчин с эпилепсией AED, включая карбамазепин, окскарбазепин и вальпроат, вызывают изменения половых гормонов, морфологии и функции сперматозоидов. В литературе сообщалось, что карбамазепин, используемый при пограничном расстройстве личности, вызывает депрессию. Топирамат демонстрирует выраженные неблагоприятные когнитивные эффекты у эпилептиков, включая исполнительную когнитивную дисфункцию и отчетливую аномию, но эти эффекты, по-видимому, не так заметно упоминаются в ограниченной литературе по психиатрическому применению топирамата. Аналогичным образом, сообщения о паркинсонизме и когнитивных нарушениях, вызванных вальпроевой кислотой, которые неоднократно появлялись в неврологической литературе, почти полностью отсутствуют в психиатрической литературе.
AED вызывают потерю костной массы и повышенный риск переломов благодаря множеству механизмов, в частности, за счет снижения уровня витамина D в сыворотке и увеличения обмена костной ткани. Индукторы ферментов и ингибиторы ферментов разделяют этот побочный эффект, но доказательства его возникновения у более новых AEDs ограничены. Например, ламотриджин может не вызывать потерю костной массы
Некоторые антидепрессанты вызывают заметные изменения в уровнях AED, в то время как другие (такие как циталопрам, эсциталопрам и сертралин) этого не делают.
Топирамат
Топирамат изучен не так хорошо, но открытые исследования указывают на хорошую переносимость и эффективность при неклассической мании.
Левирацетам
Леветирацетам представляет значительный интерес для биполярного расстройства, с сообщениями о пользе для мании, депрессии и быстрой смены фаз , но адекватных данных нет. Ограниченные неконтролируемые данные свидетельствуют о полезности зонизамида и тиагабина при биполярном расстройстве.
Габапентин
По имеющимся данным, габапентин не эффективен при биполярном расстройстве. Тем не менее, габапентин – привлекательное соединение из-за благоприятного профиля побочных эффектов и отсутствия лекарственных взаимодействий – представляется ограниченным доказательством того, что он широко используется при состояниях тревоги, включая социальную фобию, посттравматическое стрессовое расстройство, паническое расстройство и отмену опиатов К счастью, электросудорожная терапия может безопасно проводиться у пациентов, получающих AED (и действительно у пациентов с эпилепсией).
Было показано, что ламотриджин эффективен (в сочетании с клозапином) в лечении пациентов с резистентной формой шизофрении. Антиглутаматергическое действие ламотриджина представляет особый интерес из-за акцента на глутаматергические механизмы при шизофрении; Ламотриджин посредством ингибирования высвобождения глутамата может быть синергичным с клозапином, который является антагонистом глутамата. Из новых AED ламотриджин вызвал особый интерес. Его эффективность при биполярной депрессии была предвещена сообщениями об эффективности против депрессивных симптомов у пациентов с эпилепсией. Доказательства его острых и профилактических эффектов против биполярной депрессии теперь доступны, и эффективность против маниакального рецидива в поддерживающей терапии также находит поддержку. Является ли он эффективным, поскольку лечение острых состояний при мании является менее актуальным клиническим вопросом, а необходимость медленного титрования не позволяет использовать его во многих таких случаях.
Выбор противоэпилептического препарата: эффективность и когнитивный профиль
Информация только для специалистов в сфере медицины, фармации и здравоохранения!

Успешное применение со второй половины XIX в. в практике лечения эпилепсии бромидов, а затем с 1912 г. – фенобарбитала сформировало у врачей представление о связи противосудорожного и седативного эффектов. Однако введение в лечебную практику в 1938 г. фенитоина показало, что выраженный седативный эффект не является обязательным свойством противоэпилептического препарата. К 60-70 гг. XX в. не была решена и другая проблема противоэпилептической терапии – лекарственные взаимодействия. Барбитураты, фенитоин, карбамазепин усиливают метаболизм сопутствующих препаратов за счет индукции ферментов системы цитохром P450, вальпроат подавляет метаболизм ряда препаратов. Препараты II поколения уже характеризуются минимальными лекарственными взаимодействиями и в целом лучшей по сравнению с традиционными препаратами переносимостью при близкой эффективности. Назначение противоэпилептического препарата с благоприятным когнитивным профилем при прочих равных условиях положительно сказывается на качестве жизни пациента.
Одним из новых, зарегистрированных в РФ противоэпилептических препаратов, в наибольшей степени отвечающих требованиям, предъявляемым к препаратам II поколения, является леветирацетам (кеппра, ЮСБ СА, Бельгия).
Леветирацетам, как и пирацетам, представляет собой производное пирролидина (S-энантиомер ?-этил-2-оксо-1-пироллидин-ацетамид). Препарат обладает уникальным механизмом действия, отличным от механизма действия любого другого противоэпилептического препарата, он связывается с протеином синаптических пузырьков SV2A и модифицирует его действие.
Леветирацетам обладает линейной фармакокинетикой. Препарат связывается с белками плазмы менее чем на 10%, не стимулирует и не ингибирует печеночные ферменты, что обеспечивает минимальный риск лекарственных взаимодействий с другими препаратами. Это было подтверждено в исследованиях.
Как и большинство новых противоэпилептических средств, препарат кеппра испытывался в режиме дополнительной терапии при криптогенных и симптоматических парциальных эпилепсиях (КСПЭ) у взрослых больных (у пациентов 16 лет и старше). В таком качестве леветирацетам на момент написания этой статьи зарегистрирован в РФ. Доступные лекарственные формы – таблетки по 250, 500, 1000 мг. В США препарат разрешен для применения при фокальных эпилепсиях у детей с 4-летнего возраста, выпускается раствор для орального применения 100 мг в мл, удобный в педиатрической практике. Снижение разрешенного возраста и появление детской формы препарата (раствора для орального применения) ожидается и в РФ.
Дозировки и способ применения
Леветирацетам относится к препаратам, не требующим длительной титрации. Рекомендованные дозировки у взрослых 1000-3000 мг/сут., разделенные на два приема, в рамках клинических испытаний доза достигала 4000 мг в сутки. Препарат может быть сразу назначен в минимальной терапевтической дозе (1000 мг/сут.), через 2 недели доза может быть увеличена до 2000, еще через 2 недели – до 3000 мг/сут. Детям препарат назначается в дозе от 20 до 60 мг/кг массы тела. Действие препарата начинается уже в первый день применения.
Леветирацетам при криптогенных и симптоматических фокальных эпилепсиях
Одним из масштабных исследований эффективности леветирацетама как дополнительной терапии было исследование KEEPER™. В открытое мультицентровое исследование были включены 1030 пациентов в возрасте 16 лет и старше с КСПЭ, резистентных к предшествующей терапии. Препарат назначался в дозе 500 мг 2 раза в сутки, затем в конце второй и четвертой недели доза увеличивалась на 500 мг. Максимальная доза составила 1500 мг 2 раза в сутки. Затем доза оставалась неизменной в течение 12 нед. Снижение частоты приступов на 50% было достигнуто у 57,9% пациентов, на 75% – у 40,1%. У 20% пациентов приступы прекратились. Наиболее частыми побочными действиями были сонливость, астения, головная боль, которые оценивались как умеренные или средние. Результаты исследования KEEPER™ подтверждают результаты проведенных ранее двойных слепых исследований эффективности и переносимости леветирацетама.
Кеппра как дополнительная терапия резистентных парциальных эпилепсий у детей изучался Glauser T.A. et al. (2002). В открытое исследование были включены 24 ребенка в возрасте от 6 до 12 лет. Базовый период составил 4 нед., затем за 6 нед. доза титровалась до 40 мг/кг массы тела в сутки, и следовал 8-недельный период наблюдения. У 52% детей частота приступов снизилась более чем на 50%, у 2 пациентов за период наблюдения приступов не было. Не отмечено влияния леветирацетама на концентрацию других препаратов. Наиболее частыми побочными действиями были головная боль, инфекция, снижение аппетита, сонливость.
В исследование Lagae et al. (2005) были включены 67 детей от 6 мес. до 16 лет, получавших леветирацетам как дополнительную терапию, и 10 детей от 4 до 16 лет – как монотерапию. Препарат назначался как при парциальных, так и при генерализованных приступах. Дозы варьировали от 12 до 62 мг/кг массы тела в сутки, в среднем 33 мг/кг/сут. Через 20 нед. после начала лечения леветирацетамом частота приступов снизилась в среднем на 60% (50% в группе получавших дополнительную терапию, 81% – в группе монотерапии). Показана одинаковая эффективность леветирацетама при генерализованных и парциальных приступах. Наиболее частыми побочными эффектами были утомляемость (7,8%) и агрессивность (5%), частота побочных эффектов была ниже в режиме монотерапии.
Леветирацетам при идиопатических генерализованных эпилепсиях
Эффективность применения леветирацетама при идиопатических генерализованных эпилепсиях (ИГЭ) исследовалась Krauss G.L. et al. (2003) и Di Bonaventura et al. (2005) [7,8]. В первом исследовании препарат был назначен 55 больным, резистентным к предшествующей терапии, в стандартных дозах в режиме дополнительной терапии, а в ряде случаев – с последующим переводом на монотерапию. Снижение частоты приступов более чем на 50% было достигнуто у 76% пациентов, полная ремиссия наступила у 40% пациентов, а у 15% препарат был отменен из-за побочных действий (в основном сонливости). Авторы отмечают, что леветирацетам может быть назначен пациентам с ИГЭ, у которых предшествующая терапия вальпроатами, топираматом или ламотриджином оказалась либо неэффективной, либо непереносимой, и подчеркивают, что эффективность ламотриджина, по предварительным данным, при юношеской миоклонической эпилепсии сохраняется более 5 лет. В другое исследование были включены 19 пациентов в возрасте от 8 до 42 лет со следующими формами ИГЭ: юношеской миоклонической эпилепсией (8 пациентов), юношеской абсансной эпилепсией (5), детской абсансной эпилепсией (4) и миоклонией век с абсансами (2). В 11 случаях леветирацетам был назначен как монотерапия, в 8 – как дополнительная терапия. Суточные дозы составляли от 1500 до 3000 мг, срок наблюдения составлял от 6 до 10 мес. У 13 пациентов приступы прекратились, у 5 было достигнуто значительное снижение их частоты, и только у 1 пациента с миоклонией век с абсансами частота приступов не изменилась. Препарат хорошо переносился, ни один из пациентов не сообщал о побочных действиях.
Антимиоклоническое действие леветирацетама
Для лечения миоклонических приступов традиционно применяются препараты вальпроевой кислоты и клоназепам. При прогрессирующих миоклонус-эпилепсиях, в частности болезни Унверрихта-Лундборга, дополнительно для коррекции затрудняющего повседневную двигательную активность миоклонуса действия используются высокие дозы пирацетама (ноотропил, ЮСБ, Бельгия). Эффективная доза препарата у взрослых составляет от 9 до 30 г в сутки. Структурное сходство леветирацетама и пирацетама позволяет рассчитывать на наличие антимиоклонического эффекта у последнего. Magaudda A. et al. назначили леветирацетам 13 пациентам (14-42 лет) с болезнью Унверрихта-Лундборга. Значительное улучшение было достигнуто у 8 пациентов, у 1 препарат был отменен из-за побочных действий и неэффективности. У части пациентов полностью заменить пирацетам на леветирацетам не удалось. Рекомендовано раннее начало терапии и использование сочетания леветирацетама и пирацетама. Подобная схема позволяет снизить необходимую дозу пирацетама.
Леветирацетам официально зарегистрирован FDA (США) как препарат для лечения миоклонических приступов при юношеской миоклонической эпилепсии у взрослых и подростков 12 лет и старше.
Леветирацетам при эпилептических энцефалопатиях
В предлагаемой «диагностической схеме для людей с эпилептическими приступами и эпилепсией» вводится новый термин «эпилептические энцефалопатии» – состояния, при которых нарушения функций мозга вызваны эпилептиформной активностью самой по себе. В группу эпилептических энцефалопатий предложено включить ряд педиатрических эпилептических синдромов, таких как синдромы Веста, Леннокса-Гасто, Ландау-Клеффнера и некоторые другие.
Леветирацетам представляется перспективным препаратом для лечения эпилептических энцефалопатий из-за благоприятного когнитивного профиля и возможности быстрого наращивания дозы. В настоящее время в литературе имеются отдельные сообщения об успешном применении кеппры при эпилептических энцефалопатиях. Так Lawlor K.M. et al. описали 11-месячного ребенка с 5-месячной историей эпилепсии и 3-месячной историей инфантильных спазмов, резистентных к клобазаму. Леветирацетам привел к клинической ремиссии и исчезновению эпилептической активности на ЭЭГ. Kossoff E.H. et al. сообщили об успешном купировании приступов и восстановлении речи у девочки 5 лет с синдромом Ландау-Клеффнера на фоне монотерапии кеппрой в дозе 60 мг/кг/сут. Однако роль леветирацетама в лечении потенциально курабельных эпилептических энцефалопатий, таких как синдром Веста или заболевания, сочетающиеся с электрическим эпилептическим статусом ночного сна, нуждается в уточнении, и препарат может быть назначен только при безуспешности традиционной терапии (гормоны, вальпроаты, бензодиазепины, вигабатрин, сультиам).
Синдром Леннокса-Гасто протекает как хроническая резистентная эпилепсия с несколькими типами приступов и когнитивными нарушениями.
Целью лечения является снижение количества приступов (достижение полной ремиссия при синдроме Леннокса-Гасто маловероятно) и улучшение качества жизни. De Los Reyes E.C. et al. назначили леветирацетам в качестве дополнительной терапии 6 детям с синдромом Леннокса-Гасто. Количество миоклонических приступов снизилось на 100% у 4 больных, число атонических приступов уменьшилось более чем на 50% у 2 больных, количество тонических приступов не изменилось. Наиболее частым побочным действием была возбудимость. Авторы отмечают, что наиболее частым положительным эффектом было повышение уровня внимания.
Леветирацетам и когнитивные функции
В 80-х гг. XX столетия леветирацетам испытывался в качестве ноотропного препарата и анксиолитика и лишь с 1991 г. – в качестве дополнительной терапии парциальных эпилепсий у взрослых. В настоящее время лечение эпилепсии стало основным показанием к применению кеппры, однако в ряде исследований особо подчеркивается благоприятное влияние препарата на когнитивные функции пациентов. Исследование Cramer et al., показало субъективные позитивные изменения когнитивных функций у взрослых пациентов с эпилепсией по данным опросника QOLIE-31. Оценка когнитивных функций в баллах возросла на 4% при применении препарата в дозе 1000 мг в сутки и на 3% при применении дозы 3000 мг в сутки. На фоне плацебо оценка снизилась в среднем на 7%. Общее количество пациентов, включенных в исследование, составило 246 человек.
Аггравация приступов – явление учащения и/или утяжеления эпилептических приступов в результате назначения нового для больного противоэпилептического препарата. Учащение приступов при правильном, соответствующем форме эпилепсии назначении препарата называется парадоксальной реакцией. Согласно Elger C.E. et al., риск развития аггравации существует при назначении любого противоэпилептического препарата, варьируя в пределах 2-3% при назначении клоназепама и вальпроата и возрастая до 10% при назначении топирамата. При назначении леветирацетама детям с рефрактерной эпилепсией также следует учитывать риск парадоксальной реакции. В исследовании Nakken K.O., Eriksson A.S., Lossius R. назначение леветирацетама 44 детям с рефрактерной эпилепсией привело к увеличению частоты приступов более чем на 25% у 19 детей (44%). Риск аггравации необходимо учитывать при назначении кеппры пациентам с резистентными к предшествующей терапии приступами.
Леветирацетам: удержание на препарате
Уровень удержания на препарате (Retention rate) определяется как % пациентов, продолжающих лечение исследуемым препаратом через определенный промежуток времени, обычно через 6 или 12 месяцев от начала исследования, и является интегрированным показателем, отражающим как его переносимость, так и возможность развития толерантности к нему.
В британском исследовании Simister R.J. et. al. сравнивались уровни удержания на нескольких новых противоэпилептических препаратах у взрослых пациентов с хронической эпилепсией и задержкой умственного развития. Через 2 года после начала лечения уровень удержания составил 85% для окскарбазепина, 57% для ламотриджина, 56% для леветирацетама и 45% для топирамата. Для тиагабина и габапентина уровень удержания составил 24 и 15% соответственно. Наибольшая частота побочных действий зарегистрирована при применении топирамата (60%), наименьшая – леветирацетама (16%).
Chung S. et al. изучены показатели удержания на 5 новых противоэпилептических препаратах: леветирацетаме, ламотриджине, окскарбамазепине, топирамате и зонизамиде. Уровень удержания оценивался на 4, 12, 24, 52 и 104-й нед. Всего в исследовании проанализированы 828 назначений. Уровень удержания был наиболее высоким для ламотриджина (74,1%), за ним следовали зонизамид (60,2%), окскарбазепин (58,8%), леветирацетам (53,6%), и топирамат (44,2%). Отмена препаратов чаще всего была связана с неэффективностью (29,5%) и седативными побочными эффектами (20,5%). Как правило, препарат отменялся в первые 6 мес. терапии. Некоторые причины отмены были специфичны для конкретных противоэпилептических препаратов: нарушение поведения и возбудимость при применении леветирацетама, сыпь, связанная с приемом карбамазепина и ламотриджина. Применение окскарбазепина вызывало гипонатриемию, а топирамата и зонизамида – образование камней в почках.
Эффективность и уровень отмены леветирацетама сравнивались с другими препаратами II поколения в мета-анализе Otoul C. et al. (2005). Результаты трех двойных слепых исследований уровня ответа на леветирацетам/плацебо как дополнительную терапию (всего 592 пациента на леветирацетаме) и четырех исследований уровня отмены (всего 672 пациента на леветирацетаме) сравнивались с результатами Кокрановских обзоров для габапентина, ламотриджина, окскарбазепина, тиагабина, топирамата и зонизамида. Результаты непрямого сравнения представлены на рисунке 1. Исследование показало, что при краткосрочном наблюдении у кеппры как дополнительной терапии соотношение показателей уровня ответа и уровня отмены более благоприятное, чем у других антиконвульсантов.
Заключение
Таким образом, леветирацетам является противоэпилептическим препаратом широкого спектра действия, чья эффективность доказана при применении как у взрослых, так и у детей при различных формах эпилепсии и типах приступов. Препарат характеризуется хорошей переносимостью и благоприятным когнитивным профилем. Отмечается улучшение когнитивных функций как у пациентов с нормальным интеллектом, так и в группе эпилептических энцефалопатий. К достоинствам препарата относятся: возможность начать лечение с терапевтической дозы в первый же день, отсутствие взаимодействия с другими препаратами, высокая эффективность, быстрый ответ на терапию и высокий уровень удержания на препарате.


